双波长紫外分光光度法快速测定发酵液中纳他霉素含量
2007-10-16 23:49:17 来源:食品与发酵工业 评论:0 点击:
纳他霉素是一种二十六元环多烯大环内脂类抗真菌剂,专性的抑制酵母菌和霉菌,被广泛用作天然生物性食品防腐剂和抗菌添加剂[1]。纳他霉素(Na-tamycin)又名匹马霉素(Pimaricin),主要由链霉素菌属中的纳塔尔链霉菌(Streptomycesnatalensis)、恰塔努加链霉菌(Streptomyceschattanovgensis)和褐黄孢链霉菌(Streptomycesgilvosporeus)等产生菌经过发酵提炼精制而成[2]。美国药典中纳他霉素成品的含量测定是采用高效液相色谱法[3],国内也有采用该法测定纳他霉素的报道[4],但这一方法对于纳他霉素高产菌的大规模选育和发酵过程的在线和快速离线检测具有明显缺点,如测定周期较长,样品处理及仪器要求较高,不适合大批量样品等等。国内也有采用紫外分光光度法快速测定发酵液中纳他霉素的报道[5],但单波长紫外分光光度法难以排除发酵液中各种杂质对测定结果的干扰。文中对采用紫外分光光度法快速测定发酵液中的纳他霉素进行了系统研究,并与高效液相色谱法进行了比较。
1 材料与方法
1·1 菌 种
褐黄孢链霉菌(StreptomycesgilvosporeusLK-196),由浙江大学生物工程研究所保藏。
1·2 培养基
斜面培养基(%):蛋白胨0·05,麦芽抽提物0·3,葡萄糖1·0,琼脂2·0,pH7·0。种子培养基(%):蛋白胨0·6,玉米浆0·6,葡萄糖2·0,NaCl1·0,pH7·0。发酵培养基(%):玉米淀粉2,酵母浸出粉0·5,蛋白胨0·5,葡萄糖40,pH7·0。
1·3 材料与设备
TU-1810PC型紫外分光光度计,北京普析分析仪器公司;HYQ型自动恒温培养箱,江苏常州;30L全自动发酵罐,镇江东方生物发酵设备有限公司;Waters515型高效液相色谱测定系统,Waters公司。纳他霉素对照品(美国药典委员会)。
1·4 实验方法
实验条件:将于28℃培养的斜面培养物挖块适量接种于盛有25mL种子培养基的种子瓶中,28℃,200r/min培24~36h,按照10%接种量接种于30L的全自动发酵罐中,28℃,通气量20L/min培养
144h,从72h起每隔8h取样,分别用紫外分光光度法及高效液相色谱法测定含量。样品处理:取2mL发酵液于具塞三角瓶中,加入25mL甲醇,超声处理30min,滤纸过滤,除去菌渣。取滤液适量,用70%甲醇水适当稀释后即得测定样品,用于紫外分光度法样品测定的浓度应小于6μg/mL,用于高效液相色谱法使用的样品浓度为400μg/mL。标准溶液:准确称取适量纳他霉素标准品,甲醇超声溶解,用70%甲醇水稀释到适宜浓度备用。紫外分光光度法:以70%甲醇-水溶液作为空白,分别测定样品溶液及标准溶液在303nm和290nm处的吸收值,采用单点校正法计算纳他霉素含量:
式中,C样品为待测样品的浓度(μg/mL),(A303-A290)样品为样品溶液在303nm和290nm处的吸收值的差值,(A303-A290)标准品为标准品溶液在303nm和290nm处的吸收值的差值,C标准品为标准品溶液的浓度(μg/mL)。HPLC测定方法采用美国药典29版方法[3]。
2 结果与分析
2·1 检测波长的确定
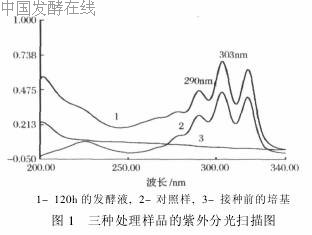
由于纳他霉素发酵液是由生物发酵得到的,在发酵培养基中使用了许多有机物质,这些物质中含有其他一些有紫外吸收的物质,在用紫外分光光度法测定时会对测定结果产生一定的干扰。分别取0h、120h的发酵液做为样品,处理得到样品溶液与标准溶液以70%甲醇-水做空白,进行全波长扫描,见图1。
从图1中可以看出,纳他霉素的最大吸收分别为290 nm,303 nm,319 nm,而发酵液中的干扰物质在纳他霉素最大吸收波长290 nm,303 nm处的吸收值分别为0·051和0·047,基本没有变化,且与纳他霉素的吸收值相差较大,因此可以选定290 nm,303 n做为纳他霉素含量测定波长,在此处杂吸收的△Aλ2-λ1≈0,因此可以最大限度地剔除杂吸收的干扰。
2·2 线性及线性范围
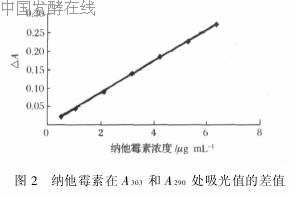
用甲醇-水溶液制备纳他霉素标准品溶液,浓度分别为0·528μg/ mL,1·056μg/ mL,2·112μg/mL,3·168μg/ mL,4·224μg/ mL,5·280μg/ mL,6·336μg/ mL,分别测定在303 nm,290 nm处的吸收值。以标准溶液浓度为横坐标,波长303 nm,290nm处吸光值的差值△A做为纵坐标,绘制标准曲线,回归方程为y =0·042 6x+0·001 4,相关系数r2=
0·999,在0·5~6μg/ mL线性良好(图2)。
2·3 精密度
分别用标准品溶液配制含量约为3μg/mL,4μg/mL,5μg/mL的标准品溶液,以甲醇-水(70%)做为空白溶液,用紫外分光光度法分别测定3次,实验结果见表1。变异系数RSD(n=3)分别为0·42%,0·31%和0·26%,平均为0·33%。此结果表明,该方法重现性较好。
2·4 准确度
取发酵结束时的发酵液样品,按照样品处理方法处理,用分光光度法测定纳他霉素的含量,在该溶液中加入已知量的纳他霉素标准品溶液,分别制备成浓度约为3μg/mL,4μg/mL,5μg/mL的纳他霉素样品,平行制备3份,用紫外分光光度法测定,计算其回收率(表2),回收率平均值为100·6%。
2·5 检测限及定量限
根据线性方程中的剩余标准偏差SD的3·3倍及10倍,分别对紫外分光光度法的定量限及检测限进行估计[4],以测定时样品的浓度表示,检测限及定量限分别为0·14μg/mL,0·41μg/mL。
3 与HPLC测定法的结果比较
对30L全自动发酵罐发酵过程中的发酵单位分别用双波长紫外分光光度法与高效液相色谱法进行跟踪测定,测定结果见表3。二者测定结果差值的平均值△UV-HPLC=1·1,取风险率α=0·02,从t分布表查得At(0·01;9)=2·821,得到△UV-HPLC的98%的置信区间为-22<△UV-HPLC<24。根据t检验结果,判断2种测定方法之间无显著差异。
4 讨 论
在生物发酵过程中,发酵液中会产生大量的有机做为纳他霉素含量测定波长,在此处杂吸收的△Aλ2-λ1≈0,因此可以最大限度地剔除杂吸收的干扰。
2·2 线性及线性范围
用甲醇-水溶液制备纳他霉素标准品溶液,浓度分别为0·528μg/mL,1·056μg/mL,2·112μg/mL,3·168μg/mL,4·224μg/mL,5·280μg/mL,6·336μg/mL,分别测定在303nm,290nm处的吸收值。以标准溶液浓度为横坐标,波长303nm,290nm处吸光值的差值△A做为纵坐标,绘制标准曲线,回归方程为y=0·0426x+0·0014,相关系数r2=
0·999,在0·5~6μg/mL线性良好(图2)。
相关热词搜索:纳他霉素
上一篇:产谷肤甘肤重组巴斯德毕赤氏酵母发酵条件的研究
下一篇:甘氨酸的生产与应用
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)