一种快速、高效分离微生物转化产物5 氟尿苷的方法
2007-04-18 17:34:22 来源:天然产物研究与开发 评论:0 点击:
商品氟铁龙(Furtulon),5′ 脱氧 5 氟尿苷(5′ deoxy 5 fluoro uridine,5′ DFUR),是一种良好的抗肿瘤药物。其主要作用机制是:抑制胸腺嘧啶脱氧核苷酸合成酶,阻断尿嘧啶核苷酸转变成胸腺嘧啶核苷酸,影响DNA的合成,从而阻止肿瘤生长。此外,还能掺入RNA,通过阻止尿嘧啶和乳清酸掺人RNA而达到抑制RNA合成的作用。临床用于治疗胃癌、结肠癌、直肠癌、乳腺癌、宫颈癌、膀胱癌等。临床研究表明,5′ DFUR治疗癌症的总有效率为35%(8/23),PS评级好转率为56%(13/23)[1 3]。近年来研究发现,5′ DFUR与环磷酰氨、秦索帝等结合服用可有效的治疗顽固转移性乳腺癌和转移性前列腺癌[4,5]。由于5′ DFUR有选择性抗肿瘤、抗肿瘤转移、改善恶性液质的特点,具有疗效高、毒副作用小、延长生命和改善生命质量等优越性。因此,该药是目前临床用于治疗癌症的主要化疗药物之一,故而市场需求量大。近年来,利用微生物产生的某些酶类,如核苷磷酸化酶、脱氧核糖转移酶及腺苷脱氨酶合成核苷类抗病毒、抗肿瘤药物取得了较大的发展[6]。但是,生物转化法所面临的一个最关键的技术问题就是转化产物的分离。例如采用生物转化合成5 氟尿苷。
啶环5 C上的H被F取代,二者在极性上的差异很小,因此很难将5 氟尿苷从反应液中分离出来,致使该转化法的技术推广受到限制。阮期平等[7]曾报道了一种5 氟尿苷的分离方法,即“两次硅胶柱色谱和两种展层系统洗脱”,但存在着分离周期长、洗脱剂用量大及样品处理量少等缺点,因此只适合于少量分析用样品的制备,而不能用于大规模生产。最近,我们建立了一种采用“干燥柱真空色谱(drycolumnvacuumchromatogra phy,DCVC)”分离5 氟尿苷的方法。其原理是:溶剂洗脱是不连续的,当在进行溶剂洗脱时,是将原有溶剂在真空下全部抽出,使固定相“干”后才加入新的洗脱剂作下一回组分的收集,其原理类似薄层色谱的多次展开。这种方法高效、快速,对于那些极性小、难分的生物转化产物的分离不失为一种好的途径。本文介绍利用此方法分离5 氟尿苷的过程。1 材料与方法
1.1 实验材料产气肠杆菌(Enterobacteraerogenes)突变株EAM Z1,由本实验室经诱变筛选而得。对照品:尿嘧啶、5 氟尿嘧啶、尿苷、5 氟尿苷(美国Sigma公司);尿苷(上海太平洋生物高科技有限公司);5 氟尿嘧啶、GF254高效硅胶板(浙江四青生化厂);其余试剂均为国产分析纯。
1.2 样品液的制备参照文献[7]的方法。将产气肠杆菌接种于液体培养基中,于31℃培养18~24h,离心(8000rpm,10min)收集湿菌体。将湿菌体加入30mmol/L磷酸盐缓冲液(含10mmol/L尿苷和30mmol/L5 氟尿嘧啶,pH7.8,菌体浓度10%)中,于60℃水浴震荡反应8~16h,用3mmol/LHCl终止反应,离心(8000rpm,30min),收集上清液。上清液于旋转蒸发仪上浓缩至1/10体积(水温75℃),4℃下静置24h,离心(16000rpm,30min),得样品液。
1.3 样品分析
1.3.1 薄层色谱(TLC)将样品点于GF254硅胶板上,展开剂:二氯甲烷 四氢呋喃(4∶1),在紫外分析仪(λ=254nm)观察。
1.3.2 高效液相色谱(HPLC)HPLC用于检测样品的纯度和浓度。将二氯甲烷 正丁醇(1∶1)洗脱样品上C18柱,用0.075mol/LNaH2PO4 CH3OH(98∶2)洗脱,流速1mL/min。进样量10μL。
1.4 干燥柱真空色谱(DCVC)DCVC是一种利用减压来增大流动相流速的色谱技术。这种技术的操作压是通过一个机械真空泵来实现。所有玻璃器皿、管、活塞等在真空下具有足够的耐压特性。
1.4.1 装柱将吸附剂(薄层色谱硅胶G 60或H 60,10~40μm)倾入柱(本实验采用的色谱柱规格为:8cm×2cm)中,轻敲柱排除空气腔隙,并通过洗脱液储存瓶抽真空,使吸附剂填得更加致密。当吸附剂通过真空被充分压缩后,关闭抽真空活塞,然后用一个柔韧的金属棒(在一端固定着软木塞或橡皮塞)进一步压缩顶部的吸附剂。整个吸附剂压缩至柱体积的30%~35%为宜。
1.4.2 加样采用干法上样。将样品液3mL与硅胶混匀(样品与硅胶的配比为:1/10,v/w),于旋转蒸发仪上蒸发至干(水温50~60℃)。将含有样品的硅胶干粉加入硅胶柱上部,并采用上述方法压缩至0.5~1cm,上面再覆盖一层硅胶(约2cm厚),最后放一张同样直径的滤纸片于顶部。
1.4.3 洗脱洗脱剂的选择:将样品液点于GF254硅胶板上,以采用柱层析用的洗脱液作为展层剂,在紫外分析仪上观察斑点,并计算各点的Rf值(表1)。通过TLC分析,我们选出了三种洗脱系统:乙酸乙酯 乙醇、正己烷 乙酸乙酯、二氯甲烷 正丁醇。
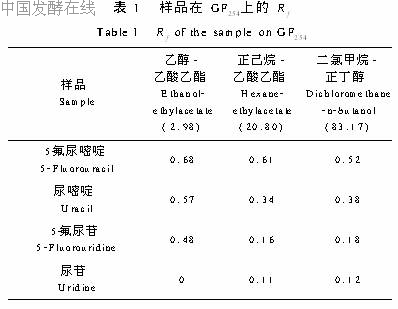
根据表1中的Rf情况,我们采用了如下洗脱路线,即:先在第一根硅胶柱上,用乙醇 乙酸乙酯系统洗脱,将样品液中的尿苷去掉;然后换第二根硅胶柱,用正己烷 乙酸乙酯系统洗脱,将5 氟尿苷与5 氟尿嘧啶、尿嘧啶分开;最后采用第三根硅胶柱,用二氯甲烷 正丁醇系统洗脱即可得到较纯净的5 氟尿苷。其整个操作过程简述如下:关闭洗脱液储存瓶活塞,打开真空泵活塞,使真空度达到0.08~0.09MPa,并保持恒定。倒入25mL洗脱液于色谱柱中,洗脱液在真空状态下迅速抽入储存瓶中。当柱中的洗脱液被抽干后,关闭真空泵活塞,打开储存瓶活塞,让洗脱液流入收集瓶中,收集洗脱液,做TLC检测。
1.5 精制将纯化的样品于旋转蒸发仪中浓缩(40℃)至1/10,加入5倍体积的乙醇,于4℃下结晶(反复2~3次),真空干燥,得5 氟尿苷产品。
2 结果与讨论DCVC各洗脱部分经TLC分析的结果见图1。
由图1可见,在乙酸乙酯 乙醇系统的洗脱部分中,乙醇 乙酸乙酯(1∶99)洗脱液中有少量5 氟尿嘧啶出现,大量的5 氟尿嘧啶、5 氟尿苷和少量尿嘧啶在乙醇 乙酸乙酯(2∶98)洗脱液中出现,而尿苷、尿嘧啶及少量5 氟尿嘧啶则存在于乙醇 乙酸乙酯(10∶90)的洗脱液中。在正己烷 乙酸乙酯系统的洗脱部分中,在正己烷 乙酸乙酯(30∶70)和正己烷 乙酸乙酯(20∶80)洗脱液中只含有5 氟尿嘧啶。5 氟尿苷则存在于正己烷 乙酸乙酯(30∶70)、正己烷 乙酸乙酯(20∶80)的洗脱液中,另外尚有极少量5 氟尿嘧啶和尿嘧啶。在二氯甲烷 正丁醇系统的洗脱部分中,在二氯甲烷 正丁醇(74∶26)的洗脱液中只有5 氟尿嘧啶和痕量尿嘧啶存在,而在二氯甲烷 正丁醇(1∶1)中则只有5 氟尿苷存在。二氯甲烷 正丁醇(1∶1)洗脱部分精制后,得到的产品作HPLC分析,结果发现,5 氟尿苷纯度在98%以上,见图2。
样品液中5 氟尿苷的浓度由公式y=106.75+3198.6x算出(式中y代表峰面积,x代表被测物浓度)。经HPLC测得3mL样品液中5 氟尿苷的含量为154mg(见图3),而纯化后得到约141mg5 氟尿苷,其得率约为92%。由此可见,我们建立的这种技术对于分离生物转化产物具有如下优点:具有相当高的分辨率。为了获得高的分辨率,我们采用了薄层色谱用硅胶,并且硅胶的装填都是在真空条件下完成,保证了整个柱都是致密、均匀的。因此对于那些结构非常相似,极性相差很小的化合物都可用此方法分开。分离操作所需时间短。这种技术所采用的色谱柱均为短柱,而且洗脱剂均在0.08~0.09MPa的压力条件下流过色谱柱,因此很快。一次洗脱仅花费几分钟时间。装置简单,用不到专用设备。装柱操作比常压与快速柱方便,要求亦不高。真空色谱所用的柱子很短(5~8cm),在真空条件下装柱往往只需十几分钟即可完成。节省试剂和硅胶。在本实验中,用洗脱液225mL就能分离样品1g,硅胶用量为7~8g,而且这些试剂价格较低廉,毒性小、易于回收再利用。样品处理量大。这种真空层析能以较快速度有效分离几十克样品。本技术借鉴生物大分子的分离策略,采用三根硅胶柱和三种不同洗脱系统,使样品中各组分分阶段分开,这既易于收集,又保证了得率,而且得到的尿苷和5 氟尿嘧啶又可继续作为转化反应的底物。此方法的不足之处是,每洗脱一次便要停止减压一次,使操作不便。我们正在设计一种多口(三口或四口)减压蒸馏收集器,以保证连续收集3~4份洗脱液。另外,使用低沸点溶剂时,要控制好真空度,防止大量溶剂蒸发逃逸。在减压抽取组分造成水蒸气在固定相表面冷凝也会降低分离效果。
上一篇:基于神经网络的头孢菌素发酵控制系统研究
下一篇:安梨酒的酿造工艺及营养成分分析
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

