一种燃料酒精的新型菌株
2007-03-02 17:00:52 来源:酿酒科技 评论:0 点击:
K 氏酵母是目前酒精工业中应用较为普遍的酿酒酵母, 但它不能分泌糖化酶水解淀粉。生料发酵是一项新兴的工艺, 被誉为我国酒精(白酒)工业发展的方向。目前的生料发酵仍需添加糖化酶系, 构建可降解淀粉直接发酵酒精的菌株则可不必添加糖化酶而直接发酵, 不仅可以缩短工艺过程,而且可以节约设备和投资。原生质体融合技术广泛应用于各类微生物遗传育种中, 单亲灭活原生质体融合技术的最大优点, 就是可以省去亲株细胞的遗传标记和提高筛选效率。较为相近的研究有酒精酵母与热带假丝酵母之间的融合及耐高温酿酒酵母与糖化酵母属间融合, 但以K 氏酵母和糖化酵母为双亲进行属间融合构建此类菌株未见报道, 实验采用紫外光单亲灭活原生质体,PEG( 6000MW) 促融, 使糖化酵母中控制产糖化酶的基因片断与K 氏酵母中调控利用可发酵性糖产酒精的基因片断发生整合并有效表达, 从而获得直接转化淀粉生产燃料酒精的能力, 使之能应用于生料发酵工业。
1 材料与方法
1.1 材料
1.1.1 菌种S.diastaticu: 购自中科院微生物研究所(AS2.1548) , 其单倍体为AS 2.1548- 1; K 氏酵母(S.cerevisiaeK): 湖北省工业微生物重点实验室保藏。
1.1.2 培养基的配制
液体完全培养基(YPD) 。固体完全培养基: 在YPD 中添加2.0 %琼脂。高渗再生培养基(YPDS): YPD +0.53 mol/L 蔗糖。琼脂: 上层0.5 %,下层2.0 %。选择培养基(SSM)为: 可溶性淀粉2.0 %, 蛋白胨0.5%, 酵母膏0.025% ,MgSO4·7H2O 0.05 %,(NH4)2SO4 0.1% 。高渗选择培养基(HSSM): SSM+0.53 mol/L 蔗糖。淀粉发酵培养基(SFM): 可溶性淀粉5.0 %, 蛋白胨0.5 % , 酵母膏0.025 %, MgSO4·7H2O 0.025 %,CaCl20.01 % ,(NH4)2SO4 0.025 %,KHPO4 0.2 %。产孢培养基I: 无水醋酸钠0.82 %,氯化钾0.186 %,琼脂2 %。产孢培养基Ⅱ: 葡萄糖0.05 %,酵母膏0.01 %,乙酸钾1.0 %, 琼脂2 %。上述培养基的pH 值皆调节到6.0, 113℃下灭菌30min。固体麸曲培养基。
1.1.3 试剂
缓冲液: ①pH6.0, 0.2 mol/L K2HPO4- 柠檬酸缓冲液(CPB) ; ②蔗糖高渗缓冲液: 0.53 mol/L 蔗糖+ CPB; ③蔗糖高渗缓冲液(CaCl2): 蔗糖高渗缓冲液+10 mmol/LCaCl2; ④高渗缓冲液(ST) : 0.53 mol/L 蔗糖+10 mmol/LpH 7.4 Tris- HCl (TB), TB (Amresco 分装) 用重蒸水配制, 用前经0.22 μm 膜过滤除菌。酶解液: 蜗牛酶/ 纤维素酶+0.8 mol/L KCL + 10mmol/L CaCl2, 用CPB6.0 配制,用前用0.22 μm 膜过滤除菌; 蜗牛酶( Snaillase) 购自北京欣经科生物技术有限公司;纤维素酶(Cellulase)购自上海伯奥生物科技有限公司。
预处理剂: 0.1 mol/L EDTANa2 + 0.1 % β- 巯基乙醇(BME ,Merck 分装) ,用CPB6.0 配制。
促融剂:6000MW 35 %PEG 用TB 配制(内含5.0 %蔗糖、10 mmol/L CaCl2), 用前用0.22 μm 膜过滤除菌。
1.2 方法
菌体的单倍体化: 酵母经产孢前培养后接至产孢培养基中, 30 ℃培养3 d, 用ST 液洗下菌体, 离心洗涤, 用2.0 %蜗牛酶作用30 min, 离心后加少量硅藻土充分研磨, 加ST 悬浮, 静止取上清液, 稀释涂YPDS 平板, 培养2 d, 挑选最小的菌落分别接入生孢培养基中。在产孢前培养基Ⅱ上培养1 d。再将培养物涂于产孢培养基I 斜面上, 10 d 后仍不见产孢, 获得糖化酵母单倍体AS2.1548- 1, K 氏酵母则为K- A- 1。
原生质体的制备与再生: 将斜面上的S.diastaticus和K 氏酵母经液体完全培养基于30 ℃,150 r/min 培养13~15 h 后取5 mL 菌液,用CPB 缓冲液洗涤3 次,并按梯度适当稀释后涂平板。菌液浓度保持在107 个/mL, 再用0.1 % β- 巯基乙醇预处理10 min, 加入3.0 mL 2.0 %蜗牛酶于30 ℃, 200 r/min 振荡酶解。酶解完毕后用高渗缓冲液洗涤2 次并悬浮,用无菌水梯度稀释涂基础培养基,用高渗缓冲液梯度稀释涂再生培养基,以上培养基在30 ℃恒温培养48 h 后计数。原生质体的形成率及再生率的计算采用平板计数法。
原生质体形成与再生正交实验条件见表1。
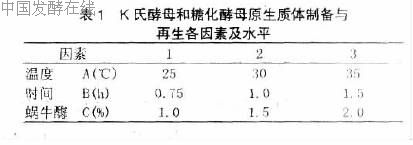
单亲灭活原生质体: 将制备好的原生质体悬液置于15 W 紫外灯下20 cm 处UV 照射30 min, 将灭活过的原生质体涂布于SSM 上, 检测是否灭活彻底。原生质体融合: 将灭活原生质体和K 氏酵母原生质体按1∶1 的比例混合后置于35 %PEG 中, 混匀, 30 ℃水浴振荡处理10 min。融合菌液用蔗糖高渗缓冲液(CaCl2) 洗涤3 次。取少量适当稀释后涂于HSSM 和YPDS, 30 ℃培养7 d。记录HSSM 和YPDS 两种培养基上的菌落数。挑取HSSM 上的小菌落转接在MM 上培养, 连续传代10 次, 将稳定的融合子转至YPD 斜面上再传代10次, 能稳定遗传的即视为真正的融合子保存。
1.2.1 融合子的鉴定
细胞大小及DNA 含量的测定。
1.2.2 融合子的性能测定
菌体生物量的测定。
菌株乙醇耐受性的测定: 活化的融合子和亲本分别接种在100 mL 含不同酒精度的YPD 液体培养基中, 30℃振荡培养48 h 后观察其生长情况。融合株α- 淀粉酶和糖化酶(GA)活性的测定: S.diastaticus和融合子分别接种于固体曲培养基, 30 ℃培养4 d, α- 淀粉酶、糖化酶活力测定按照文献[11], α- 淀粉酶酶活力单位定义:1 g 干固体曲, 在60 ℃, pH 6.0, 1 h下液化可溶性淀粉的量(g); 糖化酶酶活力单位定义: 1 g干固体曲, 在30 ℃, pH4.6, 1 h 内水解可溶性淀粉为葡萄糖的量(mg)。
1.2.3 融合子的发酵性能测定
将性状优良的融合子活化后接种于含200 mL 淀粉的发酵培养基YEPSF 的三角瓶中, 前18 h 发酵温度为28 ℃, 18 h 后发酵温度改为30 ℃, 3 d 后测其酒精含量和淀粉利用率。
微生物原生质体融合技术起源于20 世纪70 年代,由于不需要了解双亲特性, 而且可以冲破种、属的界限,因而广泛应用于各类微生物遗传育种中。本研究采用的是单亲灭活原生质体融合技术, 它的最大优点就是可以省去亲株细胞的遗传标记, 提高了筛选效率。经过一系列的活化、单倍体化、酶解破壁、融合及筛选, 终于成功构建出一株淀粉利用率达68.7 %的新型融合子, 在含5.0 %可溶性淀粉发酵培养基中, 终发酵液酒度可达7.0 %(v/v), 展现出其良好的转化淀粉和发酵产酒精潜力。虽略逊于庞小燕等筛选出的融合子, 但明显高于曾云中等的融合子, 且已达到工业化生产基本要求, 应用于生料发酵生产燃料酒精行业, 前景十分广阔。
上一篇:富硒酵母的研究开发与应用
下一篇:法夫酵母产虾青素发酵促进剂的研究
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

