刺孢霉素族抗生素的研究进展
2007-11-08 21:15:48 来源:中国新药杂志 评论:0 点击:
1987年,美国氰胺公司Lederle实验室从Texas州生硝和白垩土壤中分离出一种稀有的放线菌刺孢小单孢菌(Micromonospora echinosporassp. calichens-is),并从它的发酵液中得到了7种化合物,被称为刺孢霉素族抗生素(CLM),它与新制癌菌素(NCS和力达霉素(C-1027)同属烯炔类抗肿瘤抗生素,在结构上CLM属于十元环状烯二炔,而NCS和C1027则属于九元环状烯二炔。CLM对多种G+和G-菌有很强的杀灭力,更为重要的是用量极小即可
对多种肿瘤具有强杀伤作用,且化学结构新颖,后被研发成为临床肿瘤治疗的一类重要药物。现就CLM族抗肿瘤抗生素的研究进展和临床应用前景进行综述[1]。
1 化学结构
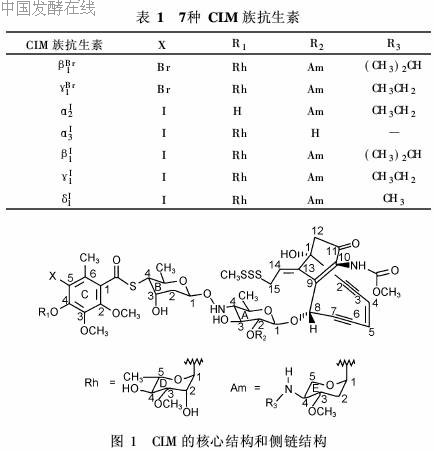
CLM为十元环状烯二炔抗生素,平均相对分子质量为1 500,具有一个刚性的双环核心,上面带有2个羟基侧链R1和R2,7种CLM族抗生素取代基的不同见表1,CLM核心结构及其侧链结构见图1[1]。
其中CLMγI1活性最强,也是临床上运用最多的。其分子结构分为3部分-寡糖、刺孢酮和甲基三硫。分子中的寡糖部分作为CLMγI1的识别体和传递体,使药物分子与DNA的小沟很好地吻合连接;刺孢酮作为高效的DNA裂解剂是抗肿瘤的活性部分;而甲基三硫则作为激发装置,引发使DNA裂解的决定性的化学反应[2]。
2 作用机制
20世纪70年代初, Bergman研究发现“烯-二炔”体系可通过形成1, 4-脱氢苯双自由基形成环化,该过程称Bergman环化,环化过程见图2。CLM首先通过其分子结构中的寡糖部分与DNA结合,经Bergman环化完成活化过程,接着由双自由基迅速夺取肿瘤细胞DNA骨架上的氢原子引起DNA断裂,从而导致肿瘤细胞死亡,反应过程见图3[3]。此外, Zein和Walker等研究表明CLMγI1对DNA的攻击具有序列专一性,即首先与DNA双螺旋的小沟上的TCCT位点结合。这与CLMγI1分子的运载系统寡糖部分和DNA链不同碱基间的作用强弱有关[4]。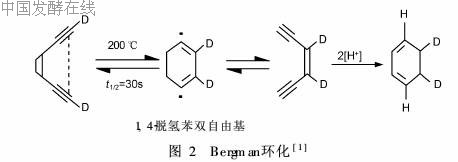
3 化学合成[1]
1992年,Nicolaou等利用低聚糖片段和“烯-二炔”糖苷配基,经Schmidt烯亚胺法偶联,再逐步引入甲基三硫体系,还原C=N键,经过10步反应首次完成了CLMγI1的全合成。
4 临床应用
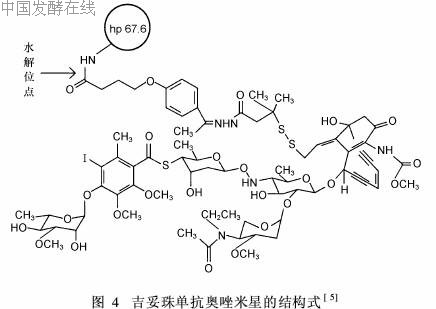
运用抗体导向化疗(ATC)是近年来治疗肿瘤的新方法,它能将抗肿瘤药物直接靶向递入肿瘤细胞大大提高了疗效,降低了不良反应。吉妥珠单抗奥唑米星(CMA-676)是由人源化的抗CD33的单克隆抗体吉妥珠单抗(hp67. 6)与CLM连接而成的抗肿瘤单抗偶联物,商品名为Mylotarg。其中,单克隆抗体约含98%的人源氨基酸序列。该药物于2000年5月FDA批准用于临床治疗,现已进入Ⅲ期临床试验,其化学结构式见图4[5]。
偶联物中的抗体能特异性地与CD33抗原结合,形成的复合物可被髓细胞内吞,在细胞的溶酶体内通过水解释放CLM, CLM进入细胞核,与DNA结合,引发DNA双链断裂,导致细胞死亡。体外研究表明,本品对CD+33细胞的毒性是CD-33细胞的7万余倍。正常髓细胞可以表达特征性的细胞表面抗原CD33抗原,在90%急性髓细胞性白血病(AML)患者的白血病原始细胞表面也发现CD33,但造血干细胞缺乏这种表面抗原,因而骨髓抑制具有可逆性。
临床研究表明,与接受常规化疗相比,本品的不良反应非常低,未见脱发、严重口腔黏膜炎或肠黏膜损害的发生。常见的不良反应是严重的骨髓抑制,这与CD33的表达相关。Mylotarg最早适用于60岁以上CD+33的AML首次复发且不适用细胞毒药物治疗的患者,还可用于治疗急性早幼粒细胞白血病(APL)[6]。最近Tsimberid-ou等[7]的临床研究表明Mylotarg在CD+33的急性淋巴细胞白血病(ALL)的治疗中也有活性,并且从DRocco等[8]的研究中发现患者的年龄也有所拓宽,量的病例是儿童AML和ALL患者。此外,Mylotarg对于移植于裸鼠上的人乳腺癌、骨髓癌和卵巢癌有显著疗效,尤其是卵巢癌,可使肿瘤完全消失[9]。除了用于治疗白血病,Appelbaum等[10]还将Mylotarg用于骨髓发育不良综合征(MDS)的临床研究。
5 研发热点
5·1 新型的单抗偶联物
5.1.1 CTM01 是一种鼠源性的单克隆抗体,能特异性识别上皮来源且表达MUC1抗原的实体肿瘤。Hamann等[11]研究发现,相对于早期的单抗偶联物必须靠溶酶体在pH值低的条件下水解释放活性药物,新型的单抗偶联物是带有活化酯的CLM的衍生物与抗体的赖氨酸反应而成,因而称为酰胺偶联物(amide conjugate),改造后的新型偶联物水解位点单一,水解更稳定。实验表明携带有CTM01抗体的新型偶联物给药3次,只需要300mg·kg-1的剂量就能对这些肿瘤产生完全抑制作用。虽然这种单抗偶联物在多药耐药型细胞中活性较低,但体内外实验都表明通过抗体偶联的方式可以使CLM对肿瘤的杀伤力大大提高,并且对顺铂耐药的卵巢癌细胞也同样具有活性。这表明这种新的单抗偶联物不仅对表达MUC1抗原的实体肿瘤有效,而且可用于一些耐药性的肿瘤。此外, CTM01抗体已经进行了人源化改造,经过改造的抗体对靶细胞的免疫亲和力提高了30%,且能更有效地内化入靶细胞[12]。
5.1.2 Le(y)抗原 是一种在克隆的肿瘤细胞(如乳腺癌、肺癌、卵巢癌、前列腺癌等)中高表达的特异性抗原,利用这一特点,设计了一种新的免疫偶联物,其结构是将能识别Le(y)抗原的抗体hu3S19和具有强细胞毒作用的药物CalichDMH(N-acetygamma-calicheamicin dimethyl hydrazide)用AcBu[4-(4 -acetylphenoxy) butanoic acid]linker偶联在一起,构成hu3S193-CalichDMH。Boghaert等[13]对肿瘤细胞的体外实验结果显示, hu3S193-CalichDMH与hu3S193抗体有相似的选择性,即对Le(y+)的细胞的杀伤力明显高于Le(y-)的细胞。这种杀伤力依赖于Le(y)的存在及细胞的敏感性。动物体内实验表明,对移植的人类胃癌(N87)、结肠癌(LOVO)和前列腺癌(LNCaP)均具有抑制性。总之,体内外实验均表明hu3S193-CalichDMH对Le(y+)的癌细胞具有杀伤力,这使得hu3S193-CalichDMH可能成为治疗某些癌症的新药。
5·2 被动治疗[14]
长期以来, CMA-676由于识别的抗原单一,因而在临床上运用范围有限,多局限于治疗急性髓细胞白血病。这种治疗途径必须利用特异的抗原和抗体的反应,因而被称为主动治疗(active therapy)。相对主动治疗,由于肿瘤内血管系统功能紊乱,使得肿瘤细胞允许更多的生物大分子保存在细胞内,因而不需要特异性识别抗原也能使药物在肿瘤细胞中大量堆积,这种治疗思路称为被动治疗。将抗体与CLM用一种酸不稳定的linker连接,且携带者为免疫球蛋白(如果替换为白蛋白或是PEGylated FC则会使偶联物的疗效降低甚至消失),改造后的单抗偶联物用于裸鼠实验,结果表明在10种缺乏CD33抗原的异种肿瘤模型中anti-CD33抗体和CLM的偶联物都有堆积的现象。这一发现可能发展成为一种新的肿瘤治疗途径。
5·3 联合用药
CMC-544是一种特异性识别CD22抗原,并携带有CalichDMH(一种CLM的衍生物)的免疫偶联物,其抗体部分为人源化的IgG4。抗体与药物以AcButlinker连接。Dijoseph等[15]经过体外和体内实验表明CMC-544对B-细胞淋巴瘤(BCL)的治疗是有效的。此外,CMC-544现在还用于B细胞型非霍奇金淋巴瘤(B-NHL)的治疗。利妥昔单抗(美罗华, rituximab)是以CD20为靶向的抗体,也可用于B-NHL的治疗。Dijoseph等[16]还在治疗BCL过程中将CMC-544和利妥昔单抗单独用药与联合用药进行比较,实验显示利妥昔单抗对肿瘤细胞的杀伤力存在着抗体依赖性和补体依赖性,而CMC-544则没有这种特性;且利妥昔单抗对处于生长中肿瘤的疗效要比已成形肿瘤的疗效要好,而CMC-544则没有这种差异。BCL裸鼠实验模型结果表明,利妥昔单抗和CMC-544单独给药分别使20%和60%的裸鼠存活了125 d,而联合给药则使90%的裸鼠存活超过了125 d。实验结果证实,虽然单独给药也能抑制肿瘤的生长,但显然联合给药效果更明显。
5·4 治疗领域的拓展:自身免疫性疾病
一种引发B细胞耗损的免疫偶联物(即anti-CD22单抗与CLM的偶联物),对CD22抗原阳性的B细胞具有特异性的识别和杀伤力。Dunussi-Joanno-poulos等[17]研究表明,在一种用鼠胶原诱导的关节炎(CIA)模型中, B细胞的耗损抑制了关节炎的进程,而且在呼吸道合胞病毒(RSV)接种的鼠实验模型中,B细胞的耗损并不影响针对RSV的抗体反应。这首次证明了B细胞的减少仅与防治关节炎有关,而与抗体的水平并不相关。这一发现开辟了治疗自身免疫性关节炎的新思路。由于单核细胞和巨噬细胞在炎症反应和风湿性关节炎(RA)中起了重要的作用,针对这2种细胞在患者体内的过量生成,研制了一种新的单抗偶联物CD64-CLM的衍生物(CD64-CaMi),它与IgG有高度
亲和力,能定向高效杀死这些细胞。Van Roon等[18]将取自RA患者外周血和滑液中的单核细胞和巨噬细胞培养于含有CD64-CaMi的培养液中,实验显示药物能有效引发RA患者滑液中的巨噬细胞的细胞核发生碎裂,从而杀死巨噬细胞,而对于外周血中的单核细胞和巨噬细胞杀伤效果不明显。总之,实验证明使用这种药物治疗RA是可行的。
6 展望
CLM族抗生素作为抗肿瘤药物由于具有过强的细胞毒性,最初在临床应用方面受到限制。近年来,由于在结构上加以修饰,使得细胞毒性大大降低,而且,通过与特异性的单抗偶联使得对细胞的选择性增强,也缓解了不良反应,拓展了治疗领域。在抗体药物的制备方面,现今的研究趋向于寻找新疾病的相关分子靶点;通过研究微生物分离、培养、筛选的条件与方法以期获得稀缺的微生物并进而获得其产生的活性物质;对抗体进行人源化改造;以及抗体药物分子的小型化和高效化改造[19]。就CLM而言,由于其对肿瘤的杀伤活性极强,据报道,比多柔比星强1 000倍,因而CLM作为单克隆抗体偶联物的高效“弹头”药物将使得抗体药物更加小型化,从而更容易到达实体肿瘤的深处,且只要微量到达就能杀伤肿瘤细胞,进一步提高药物的疗效[20]。近年来在人工合成CLM的途径方面也有所突破。Ahlert等[21]克隆出能产生多聚乙酰合酶(PKS)的基因簇,而这种酶在不同的烯二炔类抗生素中高度保守,这预示着无论是具有发色团的烯二炔还是不具有发色团的烯二炔类抗生素都可以用相同的途径进行人工合成。运用这种方法Sherman等[22]创造了一个高度不饱和的发色团,即C-1027和CLM的生物合成的核心结构,为2种高效的抗肿瘤抗生素的组合生物合成创造了条件。这种用新的生物合成酶去创造结构新颖的化合物的方法将为医药工业提供更丰富的药物来源。相信不远的将来,经过改造的CLM族抗生素将在临床治疗上发挥更大的作用。
相关热词搜索:刺孢霉素
上一篇:产脱落酸真菌的筛选及其发酵条件研究
下一篇:链霉菌实验室培养基制备
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)