高产克拉维酸的耐甘油突变株选育及生理特性研究
2007-10-23 18:16:33 来源:中国抗生素杂志 评论:0 点击:
克拉维酸(clavulanic acid,CA)是由带小棒链霉菌(Streptomyces clavuligerus)产生的一种β-内酰胺酶抑制剂[1],虽然其自身的抗菌活性很低,但它可协同增强青霉素和头孢菌素对产生β-内酰胺酶的耐药菌的抗菌活性[2],其与阿莫西林、替卡西林制成的合剂已在临床上广泛使用。近年来人们一直在致力于提高CA产量的研究[3,4]。
克拉维酸的β-内酰胺环上的碳骨架来自甘油的三个碳原子,并且未经任何中间重新排列。Minambres等[5]研究发现,生长在以甘油为唯一碳源的限定培养基中的带小棒链霉菌存在两种不同的转运甘油分子系统:其一是组成型的甘油转运系统;其二是由甘油特异性诱导的甘油转运系统(GTS),透过细胞90%以上的甘油是由诱导的GTS转运的,其转运能力受到L-丝氨酸等物质的抑制。甘油缺乏时只能合成少量克拉维酸,却大量产生带小棒链霉菌的另一种代谢物头霉素[6]。甘油是生物合成克拉维酸所必需的物质,但当培养基中甘油含量超过110mmol/L时,克拉维酸的生物合成即受到抑制。李丹丹等[7]研究了带小棒链霉菌甘油耐受量与克拉维酸合成的关系,认为耐高甘油浓度的筛选方法可用于克拉维酸菌种的选育。孟勇等[8]以带小棒链霉菌CCRC11518(ATCC27064)为出发菌,采用物理和化学诱变剂处理,通过筛选抗终产物结构类似物舒巴坦钠突变株、底物甘油耐受性突变株、营养缺陷型突变株,获得一株克拉维酸高产突变株III50,摇瓶效价为834.8μg/ml。本文以带小棒链霉菌XC-1-35为出发菌进行紫外诱变,并结合理性化筛选,选育甘油耐受性突变株,改变菌株的生理特性,增强其GTS的活性,使之可高效转运甘油用于合成克拉维酸。同时,针对选育得到的甘油耐受性突变株,通过在发酵过程中补加甘油的方式,进一步提高克拉维酸的产量,取得了较好的研究结果。
1 材料与方法
(1)菌种 带小棒链霉菌(Streptomyces clavuli-gerus)XC-1-35,系浙江医药股份有限公司新昌制药厂保藏菌株。
(2)培养基及培养条件
斜面及平板培养 采用高氏1号培养基,28℃培养8~9d。
种子培养 250ml三角瓶装30ml培养基,置旋转式摇床28℃,220r/min振荡培养48h。培养基成分(g/L):可溶性淀粉15,甘油15,鱼粉20,CaCO33,pH6.5~7.0。
摇瓶发酵 250ml三角瓶装30ml培养基,接种量10%,28℃,220r/min振荡培养96h。培养基成分(g/L):淀粉50,甘油5,黄豆粉30,玉米浆5,CaCl20.1,NaCl 0.1,FeSO4·7H2O 0.1,MgCl2·6H2O 0.1,KH2PO40.8,CaCO33,pH6.5~7.0。
(3)分析方法
克拉维酸含量测定 发酵液采用6mol/L盐酸调pH至3.5~4.0,3500r/min离心10min,去除菌丝体和固体残渣,吸取5ml上清液,12000r/min离心10min后,用重蒸水适当稀释,供HPLC检测。色谱条件为:色谱柱C18,ODS(4.6mm150mm),柱温25℃。检测器:VWD(SPD-10A),检测波长220nm,流动相:0.02molKH2PO4∶乙腈(400∶12,体积比),流速0.7ml/min,进样量10μl。菌丝浓度测定 取10ml发酵液,4000r/min离心15min,测得沉淀物在发酵液中所占的比例即为菌丝浓度。
pH测定 pH电极测定。
(4)菌种诱变处理
单孢子悬液的制备 将冷冻孢子移种子斜面,培养成熟后加入500μg/ml的无菌咖啡因溶液(作助变剂),刮下孢子并打散,用无菌滤纸过滤即得。诱变处理 吸取5ml单孢子悬液于无菌平板中,置于功率为30W,波长253.7nm的紫外灯直下30cm处开盖振荡照射60s,避光放置过夜,取样经梯度稀释后涂平板,28℃,避光培养9d左右,挑取单菌落转接斜面。
(5)甘油耐受性突变株的筛选 将经紫外线照射的孢子悬液稀释后,分别涂布于含有一定甘油浓度的分离平板上,28℃培养9~12d。
2 结果与讨论
2.1 甘油耐受性突变株的筛选
带小棒链霉菌存在着甘油诱导的甘油转运系统(GTS)[5],在甘油耐受性高的菌株中GTS活力强,可高效转运甘油合成克拉维酸[7]。为此,试验中采用耐受高浓度甘油的平板筛选UV诱变后的突变株。
(1)菌株XC-1-35对甘油的耐受性考察 分别将
未诱变处理和经UV诱变处理后的XC-1-35菌株的单孢子悬液,采用梯度稀释后涂布于含不同浓度甘油的分离平板上,结果如表1所示。研究发现,未经处理的对照组在含12%以上甘油浓度的平板上无菌落生长,其甘油耐受浓度为10%;经UV诱变处理的诱变组在含14%甘油浓度的平板上还可生长出少量呈光秃型的小菌落,并且随着平板中甘油浓度的增加,菌落的生长速度也随之减慢,其培养时间由对照的9d延长到13d。
(2)甘油耐受性突变株的选育 将经UV诱变处理60s后的XC-1-35单孢子悬液适当稀释后涂布在含14%甘油浓度的分离平板上进行培养,筛选耐高甘油浓度突变株,共挑取了93支耐受菌株转接斜面。摇瓶发酵初筛及复筛结果表明,采用筛选甘油耐受性突变株的选育效果比较理想,正变率达到63.3%,负变率仅为3.3%。利用该抗性突变株筛选方法,试验中共进行了5轮的菌种选育,得到高产菌株XC-5-48的效价达1970μg/ml,为出发菌株(318μg/ml)的6.2倍。该诱变株经斜面连续传代4次,发酵效价稳定在1800μg/ml以上,表明其高产性能稳定,可用于进一步的试

验。
2.2 突变株XC-5-48与出发菌株XC-1-35的生理特性研究
Miuambres等[5]认为克拉维酸产生菌中具有两种不同的转运甘油分子系统。其中透过细胞90%以上的甘油是由甘油转运系统(GTS)转运的。GTS是一种分布于细胞膜上的透性酶(转运酶系),酶活性的最适pH为7.0,最适温度为23~35℃,Km为14μmol/L,半衰期为8h左右。该透性酶的活性中心含有-SH基团,其转运能力与细胞膜结构的完整程度相关,并受到L-丝氨酸等某些物质的抑制。为此,试验中通过向发酵培养基中添加不同浓度的影响GTS系统活性的因素,如丝氨酸、碘乙酸、脂肪酸,分别观察其对突变株XC-5-48与出发菌株XC-1-35的生长代谢及产物合成的影响,以了解突变株的生理特性。
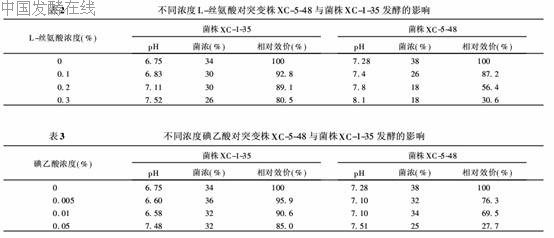
(1)L-丝氨酸的影响 分别将突变株XC-5-48与出发菌株XC-1-35的种子培养液接种在含不同浓度L-丝氨酸的发酵培养基中,进行摇瓶二级发酵,发酵96h后放瓶,测定pH、菌浓、效价,以不含L-丝氨酸的发酵培养基为对照。结果(表2)表明,L-丝氨酸不仅阻遏了克拉维酸的合成,同时还抑制了菌体的生长,随着L-丝氨酸加量的增加,抑制作用增强。L-丝氨酸对出发菌株的影响较小,当添加0.3%的L-丝氨酸量时,菌浓下降23.5%,发酵效价下降19.5%;对突变株XC-5-48添加0.2%的L-丝氨酸时,菌浓下降52.6%,效价下降44.6%,当L-丝氨酸添加量为0.3%时,效价下降了近70%。表明突变株XC-5-48的诱导型GTS系统的转运能力受到L-丝氨酸的强烈抑制。
(2)碘乙酸的影响 将突变株XC-5-48与菌株XC-1-35的种子培养液分别接种在含不同浓度碘乙酸的发酵培养基中,进行摇瓶二级发酵,发酵96h后放瓶,测定pH、菌浓、效价,以在不含碘乙酸的培养基中发酵为对照,结果见表3。从表3可知,碘乙酸对出发菌株XC-1-35的生长和产物合成影响均较小。对突变株XC-5-48而言,低浓度的碘乙酸对生长和产物合成有较显著的抑制作用,随着碘乙酸加量的增加,其抑制作用增强,当浓度达到0.05%时,菌浓下降34.2%,效价降低70%以上,表现出对菌株生长和克拉维酸生物合成都有强烈的抑制作用。据报道碘乙酸是酶活性中心含有-SH基团的膜透性酶的灭活剂。试验表明,碘乙酸能强烈抑制突变株XC-5-48的GTS的转运甘油能力,造成产量大幅度下降。
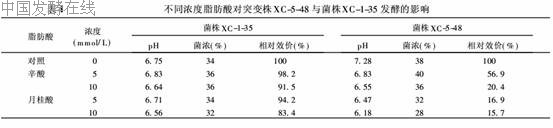
(3)脂肪酸的影响 据报道,具有表面活性的脂肪酸(C6以上)严重影响GTS转运甘油的能力,随链长的延长其表面活性增强,对GTS转运能力的抑制作用增强。GTS转运甘油能力与细胞膜结构的完整性相关[5]。
试验中将突变株XC-5-48与菌株XC-1-35的种子培养液分别接种在含不同浓度辛酸(八碳酸)和月桂酸(十二碳酸)的发酵培养基中,进行摇瓶二级发酵,发酵96h后放瓶,测定pH、菌浓、效价,以菌株在不含脂肪酸的培养基中的发酵结果为对照(表4)。从表4可知,脂肪酸对出发菌株的生长和克拉维酸生物合成有一定的影响,对突变株XC-5-48的克拉维酸生物合成表现出强烈的抑制作用。加入5mmol/L的八碳酸(辛酸)使效价较对照下降43%,而加入5mmol/L的十二碳酸(月桂酸)则使效价下降83%,表明随着脂肪链长度的增加,其对克拉维酸生物合成的抑制作用也随之增强。
2.3 甘油对克拉维酸生物合成的影响
Romero等[6]报道,甘油浓度为110mmol/L时,克拉维酸的生物合成速率最大,高于此甘油浓度,克拉维酸生物合成则受到抑制。试验中考察了不同甘油浓度及不同甘油补入时间对克拉维酸生物合成的影响。
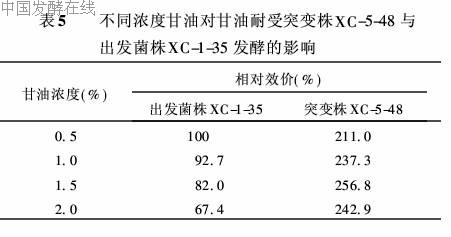
(1)不同甘油浓度对甘油耐受株XC-5-48与出发
菌株XC-1-35发酵的影响 将突变株XC-5-48与出发菌株XC-1-35的种子培养液分别接种于含不同浓度甘油的发酵培养基中,进行摇瓶二级发酵,96h后测定效价,以出发菌株XC-1-35在0.5%甘油浓度下发酵为对照。结果见表5。从表5可知,随着培养基中甘油浓度的增加,菌株XC-1-35的发酵效价随之降低,而突变株的发酵效价却不断提高,在甘油浓度为1.5%时达最高值。这充分表明在甘油耐受性突变株XC-5-48中,甘油转运系统(GTS)活力强,能高效转运甘油用于合成克拉维酸。在出发菌株XC-1-35中,GTS系统活力弱,不能快速地转运甘油,过剩的甘油造成碳氮比过高,使发酵液粘度增大,引起溶解氧浓度下降,影响克拉维酸的生物合成[7]。
(2)甘油补入时间对克拉维酸生物合成的影响
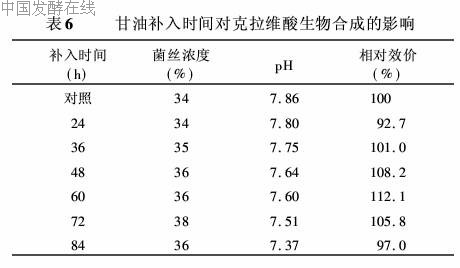
当基础培养基中甘油浓度超过一定范围时可抑制克拉维酸的生物合成,但甘油又是克拉维酸合成的直接前体,合成过程中需要甘油存在。为解决这一矛盾,试验中采取了发酵过程中补加甘油的方法。即发酵培养基初始甘油浓度为1.5%,在摇瓶发酵至24、35、48、60、7和84h时分别补入1.0%的甘油,继续培养至96h放瓶,以不补加甘油为对照,考察甘油补入时间对克拉维酸生物合成的影响,结果如表6所示。
表6结果表明,发酵至48~72h时补加甘油均能提高克拉维酸的产量,60h补加甘油的发酵效价最高,较对照提高12%,此时菌体进入大量合成克拉维酸阶段,需要大量的前体,适时补加甘油,能充分发挥菌体的产物合成潜力,大幅度提高发酵效价。过早补加甘油,由于基础料中甘油残留浓度仍较高,从而抑制克拉维酸的生物合成;补加时间过迟,由于菌体合成克拉维酸的能力下降,前体的加入对克拉维酸生物合成的作用不大。
(3)甘油最佳补入量的选择 前体在一定条件下能控制菌体合成药物的方向和增加药物产量。但过量的前体往往会影响菌体的代谢,甚至对菌体产生毒性,如过量的甘油浓度就会抑制克拉维酸的生物合成,发酵过程中须控制甘油的补入量。为研究克拉维酸发酵中前体甘油的最佳补入量,试验中采用摇瓶发酵到60h时,补入不同浓度的甘油,然后继续培养到96h放瓶,测定克拉维酸的效价,结果见图1。由图1可知,在发酵至60h时补入1%的甘油,发酵效价可达2668μg/ml,较未补加甘油的对照提高了12.5%,当甘油补入量超过1.5%时,发酵效价低于对照,说明此浓度下甘油已经对克拉维酸的生物合成产生了较严重的抑制作用。
2.4 15L罐发酵曲线
采用15L发酵罐,发酵培养基中甘油浓度为1.5%,发酵60h时补加1.0%的甘油,共进行了10个批次的上罐试验,平均发酵效价达2103μg/ml,发酵时间曲线见图2所示。
3 结论
以带小棒链霉菌XC-1-35为出发菌株,经紫外线照射筛选甘油耐受性突变株,得到高产菌株XC-5-48,其效价为出发菌株的6.2倍。该菌株传代性能稳定,而且具有活力较强的由甘油特异诱导的甘油转运系统(GTS),一些对GTS有抑制作用的物质,如丝氨酸、碘乙酸等抑制克拉维酸的生物合成,降低产量。当发酵培养基中甘油浓度为1.5%,发酵至60h再补入1.0%甘油,高产菌株能高效地转运甘油用于合成克拉维酸,效价达2668μg/ml,并且菌丝自溶速度减慢,有利于发酵过程的控制。采用选育得到的甘油耐受性菌株,并结合补加甘油工艺,在15L发酵罐上进行了10个批次的罐发酵试验,平均效价为2103μg/ml,为出发菌种的6.6倍,表明选育甘油耐受性菌株是获得克拉维酸高产菌株的有效途径之一。本试验结果对克拉维酸的代谢调控和工业化生产具有很好的借鉴和参考价值。
相关热词搜索:克拉维酸
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)