发酵乳球菌菌株的PCR鉴定
2007-04-11 15:59:38 来源:食品科学 评论:0 点击:
乳球菌(Lactococcus)广泛应用于发酵乳制品的制作工业中,发酵乳中球菌种类主要包括乳酸乳球菌(L.lactis)的2个亚种:乳酸乳球菌乳酸亚种(L.lactis subsp. lactis)和乳酸乳球菌乳脂亚种(L.lactis subsp. cremoris)以及链球菌(Streptococcus)中的嗜热链球菌(S.thermophilus),L.lactis在乳酪制作的产香和产粘过程中具有重要的作用,可为凝乳形成和风味产生提供最佳的条件[1-2]。S.thermophilus是商品化酸乳中必不可少的乳酸菌种之一[3],赋予了乳制品具有粘性、稳定性和水溶性的特点,提高了产品的口感、质地和风味[4]。由于乳酸乳球菌和嗜热链球菌无论在形态、分类学关系、基因型以及工业应用上都是非常接近的,并且在发酵乳制作中的有着不同的特性,所以对其进行菌种及菌株水平的鉴定是十分必要的。传统的鉴定方法主要依赖于表型分析,其中有些技术已被证明适用于某些乳酸菌的鉴定,但表型分析存在一些缺点,例如重现率低、某些技术的不定性(主要是由细菌生长的可塑性引起的)、低辨识能力以及相似的表型特性并不等同于相似的或者关系密切的基因型[5]。近年来,为了克服传统表型分类学方法的缺陷,已经建立了一系列的乳酸乳球菌和嗜热链球菌分子鉴定方法,包括遗传探针技术和遗传指纹技术,PCR技术的创立打开了乳酸菌快速鉴定的大门,嗜热链球菌菌种特异性引物[6-7]和乳酸乳球菌菌种特异性及其亚种特异性引物[8-9]已经建立,RAPD技术已经广泛地用于菌株水平的鉴别[10-12],此外,还建立了许多PCR衍生的鉴定技术(如S-PCR、rep-PCR、AP-PCR、LCR和小卫星序列多态性)以及基于16S rRNA基因和16S~23S rRNA基因间隔区的PCR及其RFLP,即ARDRA技术[1,6,10,13]。本实验即是进行表型特性差异的分子水平研究,首次依据嗜热链球菌和乳酸乳球菌菌种之间生化代谢的差异,比对其代谢酶编码基因的序列,尽可能设计菌种水平的较短的PCR引物,力求做出这些菌种不同菌株的PCR鉴定,为相关科学研究和工业化生产提供理论和技术基础。
1材料与方法
1.1标准菌株及其培养条件实验所用标准菌株有乳酸乳球菌乳酸亚种株AS1.1936(ATCC19435)、AS1.18、AS1.1690、AS1.2030和乳脂亚种株AS1.9以及嗜热链球菌株AS1.1864、AS1.2471、AS1.1855和无乳链球菌株AS1.1481。其中AS1.2471和AS1.1855购自中国普通微生物保藏管理中心(CGMCC),AS1.1936是由乳品科学重点实验室孟祥辰教授赠送,其余菌株均是由东北农业大学食品学院于国萍教授赠送。标准菌株的纯培养通过在无抑制作用的MRS平板培养基上反复划线进行,增殖培养在液体M17培养基中过夜生长进行。
1.2模板DNA的制备采用CTAB法制备菌株DNA样品[14],紫外(DU640型分光光度计,贝克曼)测定其OD260和OD280。选取OD260/OD280介于1.8~2.0的样品,稀释至浓度48ng/μl作为模板备用。
1.3特异性PCR
1.3.1引物设计据文献[15],选取精氨酸、淀粉、麦芽糖以及核糖代谢为切入点,查找其代谢关键酶(编码基因),分别为精氨酸脱亚氨酸酶(arcA)、α-淀粉酶(amyL/Y)、正磷酸酯葡糖基转移酶(glgP)、麦芽糖磷酸化酶(mapA)、核糖激酶(rbsK)和精/鸟氨酸反向转运体(arcD),应用DNAman软件比对相应核苷酸序列,Oligo 5.0设计菌种特异性PCR引物,详见表1(共11对,其中乳酸乳球菌9对,嗜热链球菌2对),引物合成于上海英骏生物技术有限公司。
1.3.2特异性PCR扩增
PCR反应体系为25μl,其中含TaqDNA聚合酶2.5U,10×PCR reaction buffer 2.5μl,模板DNA 1μl,dNTP浓度为200μmol/L,MgCl2浓度为1.5mmol/L,每对引物浓度为400μmol/L,补充去离子水至25μl。扩增程序如下:94℃预变性3min,94℃变性30s,退火温度复性30min,72℃延伸30min(引物对LclglgPF-R的延伸时间为40s),进行30个循环后72℃延伸7min。取9μl扩增产物进行电泳,电压为100V,琼脂糖凝胶为1%(含EB 0.5μg/L),用凝胶成像系统观察电泳结果并拍照。PCR相关试剂均购自天根生化科技(北京)有限公司。
2结果与分析
2.1菌株的分离纯化标准菌株经过反复平板划线基本得到纯化,无论是从菌落形态还是镜检观察均为均一的形态。在对AS1.2030和1.1864进行分离纯化时,可见各另有1个不均一大小的菌落形态,所以分别进行划线培养和分离,并分别将其大小菌落菌株重新命名为AS1.2030a和AS1.2030b以及AS1.1864a和AS1.1864b,因此,共得到11株乳酸菌,即AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9、AS1.1481、AS1.1864b、AS1.1864a、AS1.2471和AS1.1855。
2.2特异性PCR鉴定
2.2.1基于arcA的乳酸乳球菌特异性PCR鉴定
引物对LclarcAF-R的PCR扩增,只有菌株AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9和AS1.1864a获得了1148bp的特异性的唯一条带,其余菌株均无带,见图1。
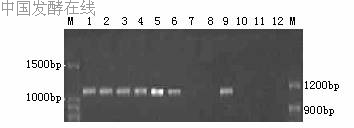

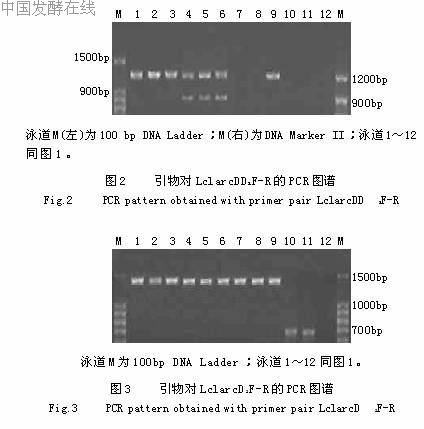
2.2.2基于arcD的乳酸乳球菌PCR鉴定基于arcD设计了2个引物对LclarcDD1F-R和LclarcD2F-R,前者扩增各菌株模板,只有AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9和AS1.1864a获得了1245bp的特异性条带,其中菌株AS1.1936、AS1.2030a、AS1.2030b和AS1.1864a是唯一条带,而菌株AS1.18、AS1.1690和AS1.9另各有一约900bp的非特异性条带,其余菌株均无带,见图2。后者的扩增结果如图3所示,所有的菌株都得到一唯一条带,其中AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9、AS1.1481、AS1.1864b和AS1.1864a为预期的1443bp的特异性条带,而AS1.2471和AS1.1855是约700bp的非特异性带。2.2.3基于glgP的特异性PCR鉴定基于glgP设计了2个引物对,分别为SttglgPF-R和LclglgPF-R,前者是嗜热链球菌种特异性的,PCR扩增仅有AS1.2471和AS1.1855得到了1606bp的特异性唯一条带,其余均无带,见图4。后者是乳酸乳球菌种特异性的,PCR扩增只有AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9和AS1.1864a得到了2346bp的特异性唯一条带,其余均无带,见图5。
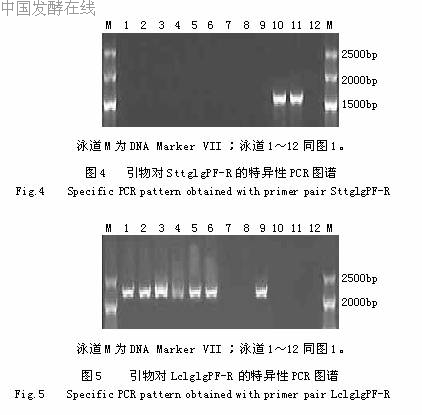
2.2.4基于amyL/Y的PCR鉴定
基于amyL设计了2个引物对,分别是SttamyLF-R和LclamyLF-R,前者是嗜热链球菌种特异性的,PCR扩增仅有AS1.2471和AS1.1855得到了1308bp的特异性唯一条带,其余均无带,见图6。后者是乳酸乳球菌种特异性的,PCR扩增只有AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9、AS1.1864b和AS1.1864a得到了1178bp的特异性唯一条带,其余均无带,见图7。此外,基于amyY还设计了1个乳酸乳球菌种特异性引物LclamyYF-R,扩增后有的菌株呈现一定的多态性,共鉴定出了6个基因型,只有AS1.2030a、AS1.2030b、AS1.1690、AS1.9、AS1.1864b和AS1.1864a有1480bp的特异性条带,且只有AS1.2030a和AS1.2030b是唯一条带,另外4株还有与形成唯一条带的AS1.18和AS1.1481一样大小的扩增子(>1500bp),AS1.1690、AS1.9和AS1.1864a只有这两条带,而AS1.1864b有三条带,另外一条是与另一有唯一条带的AS1.1936一致大小的片段(>1200、<1480bp),见图8。2.2.5基于mapA的乳酸乳球菌PCR鉴定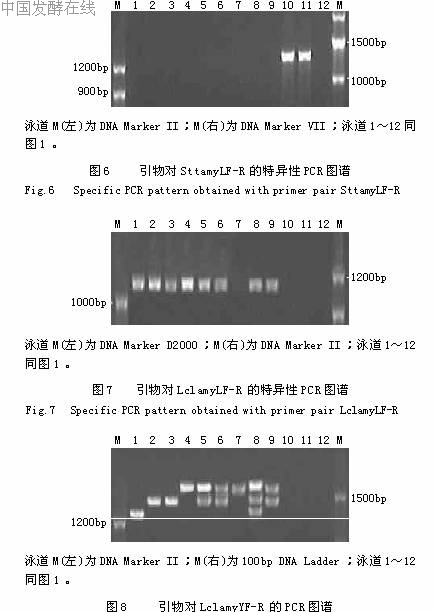
依据mapA基因设计了2个乳酸乳球菌的特异性PCR引物,虽然LclmapA1F-R扩增都得到了1001bp的特异性片段,但是所有11株菌均呈现一定的多态性,并被分成5个基因型,对鉴别有一定的意义,见图9。而LclmapA2F-R扩增只有AS1.1936、AS1.2030a、AS1.2030b、AS1.18、AS1.1690、AS1.9、AS1.1864b和AS1.1864a获得了1581bp的特异性唯一条带,其余均无带,见图10。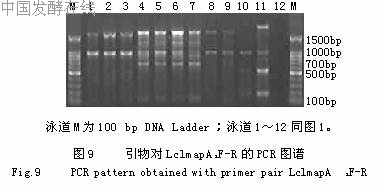
2.2.6基于rbsK的乳酸乳球菌特异性PCR鉴定引物对LclrbsKF-R的PCR扩增,仅有AS1.1936、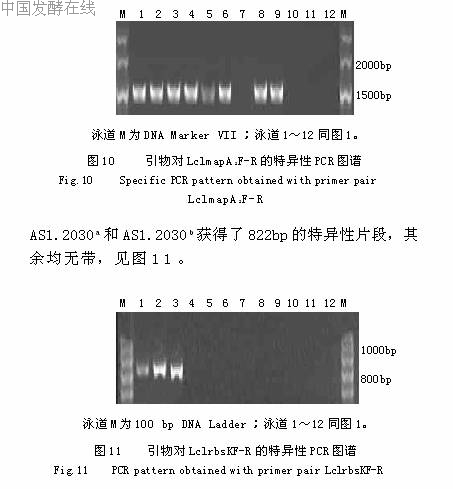
3结 论
本文依据菌落大小分别将AS1.2030和AS1.1864各分为2个菌株,PCR鉴定结果显示,AS1.2030a和AS1.2030b具有一样的基因型,因此它们是同一株,或非同一株但是难以鉴别;而AS1.1864a和AS1.1864b却得到了不同的基因型(图1、2、5、7),可以鉴定为2个菌株,而且都是L.lactis,而非初始菌株所描述的S.thermophilus,这可能是由于其本身就被L.lactis所污染的缘故。可见,菌落观察在细菌鉴定中仍然有一定的指示价值。另外,AS1.1690和AS1.9也是难以鉴别的,但也不能排除它们是同一株菌的可能性。在特异性PCR鉴定中,综合这11个图谱的结果,可以得出结论,即可对9个标准菌株进行菌株水平的鉴定,而在AS1.2030a和AS1.2030b以及AS1.1690和AS1.9之间是难以做出鉴别的。此外,还发现了4个菌种特异性PCR引物,即乳酸乳球菌的LclamyLF-R和LclmapA2F-R,以及嗜热链球菌的SttglgPF-R和SttamyLF-R;另外,引物LclamyYF-R可能是标准菌株AS1.1936的株特异性PCR引物,其变异后amyY可能有核苷酸的丢失。并以1株经证实已应用于酸乳发酵的无乳链球菌(S.agalactiae)作为对照,以达到更加可靠的分类和鉴别。
综上所述,本文所设计的特异性PCR引物是有效的,这种基于表型特性差异的分子水平鉴定方法是可靠的。本文选取6个代谢酶基因为靶标,而且有的引物也很长(远大于10-mer),没有得到较大的多态性,已将11株菌鉴定到了菌株的水平。如果选择足够多的代谢酶为靶标,据此设计足够多的PCR引物,并尽可能降低引物的长度,也可能将细菌鉴定到菌株的水平。如果在此研究的基础上,进一步采用多重巢氏PCR等技术,可能建立乳酸球菌菌株水平的快速鉴定技术。同时,这对其他乳酸菌的分类鉴定也有一定的借鉴意义。
相关热词搜索:乳球菌
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

