水稻稻瘟病拮抗菌株C-18发酵条件的研究
2007-12-18 23:03:10 来源:食品与发酵工业 评论:0 点击:
摘要:本文对稻瘟病拮抗菌C-18的摇瓶发酵条件进行了初步研究,结果表明C-18菌株的适宜发酵培养基是QH培养基,其适宜的摇瓶发酵条件是:初始pH值7.5、摇瓶装液量50ml/250ml三角瓶、发酵温度
关键词:稻瘟病;拮抗菌;发酵条件
在抗生素工业生产中,为了获得较大的收益,就必须通过最大程度的降低成本、提高产量来提高利润,发酵条件的研究正是实现这一目标的有效手段。由于时间和试验条件的限制,本试验选择对C-18菌株发酵液的培养基种类、初始pH值、温度、装液量以及培养时间这几方面进行单因素和正交试验的研究,还对发酵液的热稳定性和pH稳定性进行研究。
1 材料与方法
1.1 材料
稻瘟病拮抗菌株C-18
病原菌:水稻稻瘟病病原菌由广西大学农学院植病教研室提供。
SPX-250型生化培养箱、HVE-50自动灭菌锅、SHB-Ⅲ循环水式多用真空泵、RE
菌种保藏及试管斜面培养基:高氏一号固体培养基:参照文献[1]
马铃薯琼脂(PDA)培养基:参照文献[2]
液体发酵培养基:高氏一号液体培养基:参照文献[1]
1.2 方法[3]
接拮抗菌于高氏一号液体培养基中(
相对抑菌率(%)=(对照菌落半径-处理菌落半径)/对照菌落半径×100%
或相对抑菌率(%)=拮抗带宽度/对照菌落半径×100%
供试培养基有十种[5-7](配方见表1),培养基均调pH至7.2,装入250ml的三角瓶中,每瓶100ml,灭菌后,加入5ml培养好的液体种子,
|
表1 菌株发酵培养基配方(g/100ml) | |
|
培养基 |
成分 |
|
1 |
葡萄糖2.0 黄豆粉2.5 酵母粉0.4 淀粉1.0 牛肉膏0.005 NaCl 0.2 |
|
2 |
葡萄糖4.0 黄豆粉4.0 酵母粉0.4 硫酸铵0.3 NaCl 0.1 Na2HPO4 0.005 |
|
3 |
葡萄糖2.0 黄豆粉2.5 酵母粉0.4 淀粉1.0 牛肉膏0.1 NaCl 0.2 K2HPO4 0.005 |
|
4 |
葡萄糖2.0 黄豆粉1.5 酵母粉0.3 淀粉2.0 NaCl 0.2 CaCO3 0.5 K2HPO4 0.02 |
|
5 |
葡萄糖2.0 黄豆粉2.0 酵母粉0.1 淀粉1.0 玉米粉3.0 硫酸铵0.2 |
|
|
硫酸镁0.03 NaCl 0.2 CaCO3 0.6 K2HPO4 0.02 |
|
6 |
葡萄糖3.0 黄豆粉3.0 酵母粉0.4 玉米粉3.0 硫酸铵0.4 硫酸镁0.04 |
|
ACSI |
黄豆粉5.0 淀粉2.0 玉米粉2.0 NaCl 1.5 |
|
QH |
黄豆粉2.0 淀粉5.0 NaCl 0.2 K2HPO4 0.1 CaCO3 0.5 |
|
高氏Ⅰ号 |
淀粉2.0 硫酸镁0.05 KNO3 0.1 K2HPO4 0.05 NaCl 0.05 FeSO4 0.001 |
|
PDA |
葡萄糖2.0 马铃薯20 |
在250ml的三角瓶中装入100mlQH液体培养基,将培养基的初始pH用HCl或NaOH调成3.0,4.0,5.0,6.0,7.0,8.0,9.0,灭菌后,加入5ml培养好的液体种子,
在250ml的三角瓶中装入100mlpH8.0的QH培养基,灭菌后,加入5ml培养好的液体种子,分别放在
在250ml的三角瓶中装入pH8.0的QH培养基25ml,50ml,75ml,100ml,150ml,200ml,灭菌后,加入5%培养好的液体种子,
在250ml的三角瓶中装入50mlpH8.0的QH液体培养基,灭菌后,加入5%培养好的液体种子,
根据单因素试验的结果,选取pH、温度、装液量、培养时间四因素,pH取7.5,8.0,8.5三水平,温度取
|
表2 试验设计和实施方案表 | ||||
| ,
因素 |
pH |
温度(℃) |
通气量(ml) |
时间(d) |
|
实验1 |
7.5 |
30 |
25 |
7.0 |
|
实验2 |
7.5 |
32 |
50 |
7.5 |
|
实验3 |
7.5 |
34 |
75 |
8.0 |
|
实验4 |
8.0 |
30 |
25 |
7.5 |
|
实验5 |
8.0 |
32 |
50 |
8.0 |
|
实验6 |
8.0 |
34 |
75 |
7.0 |
|
实验7 |
8.5 |
30 |
50 |
7.0 |
|
实验8 |
8.5 |
32 |
75 |
7.5 |
|
实验9 |
8.5 |
34 |
25 |
8.0 |
|
实验10 |
7.5 |
30 |
75 |
8.0 |
|
实验11 |
7.5 |
32 |
25 |
7.0 |
|
实验12 |
7.5 |
34 |
50 |
7.5 |
|
实验13 |
8.0 |
30 |
50 |
8.0 |
|
实验14 |
8.0 |
32 |
75 |
7.0 |
|
实验15 |
8.0 |
34 |
25 |
7.5 |
|
实验16 |
8.5 |
30 |
75 |
7.5 |
|
实验17 |
8.5 |
32 |
25 |
8.0 |
|
实验18 |
8.5 |
34 |
50 |
7.0 |
(1)热稳定性试验
各取5ml发酵浓缩液,在
(2) pH稳定性试验
取7份样品,每份6ml发酵浓缩液,用 1mol/L的HCl和1mol/L的NaOH将样品分别调成pH值1,3,5,7,9,11,13后,
2 结果与分析
2.1培养基对产抗生素量的影响
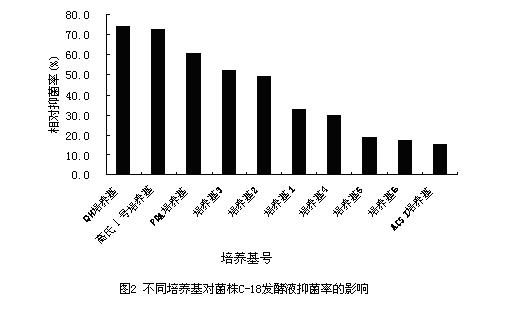
将C-18菌株接种在不同培养基中,发酵培养6d后测发酵液对稻瘟病菌的抑菌情况,结果见图2。从图中可以看出,C-18菌株在QH培养基中发酵液的抑菌率最大,因而产生的抑菌物质可能也最多。说明本试验中QH培养基最适合C-18菌株产抗菌物质。
2.2 pH条件对产抗生素量的影响
将C-18菌株接种于不同初始pH的QH培养基中,发酵培养6d后测发酵液对稻瘟病菌的抑菌情况,结果见图3。
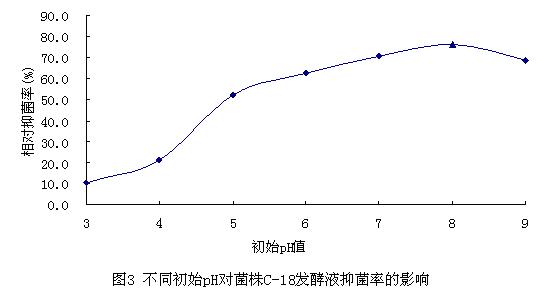
从图中可知,当pH为8.0时,相对抑菌率最高;在中性至弱酸弱碱性条件下,发酵液对稻瘟病菌的相对抑菌率仍较高,说明中性和弱酸弱碱性环境均适合C-18菌株产抗菌物质。
2.3 温度对产抗生素量的影响
将C-18菌株接种于QH培养基中,在
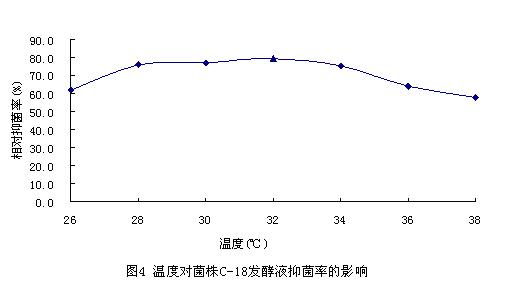
从图中可以看出,在选用的各种温度条件下,C-18菌株发酵液对稻瘟病菌均有抑菌活性,但在
2.4 装液量对产抗生素量的影响
在250ml三角瓶中分别加入QH培养基25ml,50ml,75ml,100ml,150ml,200ml,发酵培养6d后测发酵液对稻瘟病菌的抑菌情况,结果见图5。
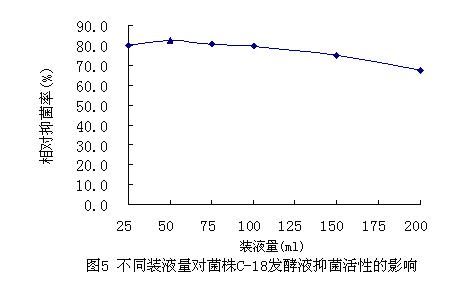
从图中可以看出,不同装液量对C-18菌株产抗生素具有不同的影响,随着供养量增加,抑菌率增大,在250ml三角瓶中加入培养基50ml时,发酵液的抑菌活性最大,抑菌率达82.5%,而装液量为25ml时,发酵液的抑菌率反而减小,可能是因为装液量过少,培养基粘在瓶壁上,真正用于菌体生长的营养成分不足,导致抑菌活性受影响。由此试验结果可以确定最佳的装液量为50ml。
2.5 培养时间对产抗生素量的影响
将C-18菌株接种于QH培养基中摇床发酵培养4d后,开始每隔12h测发酵液对稻瘟病菌的抑菌活性,结果见图6。
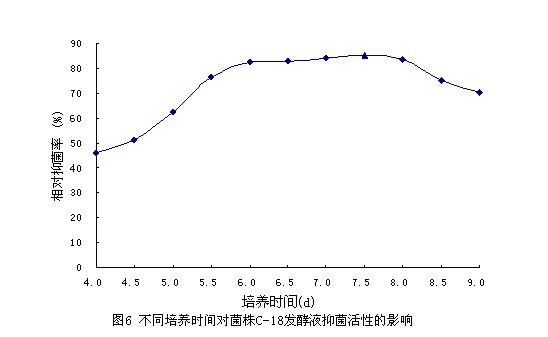
从图中可以看出,培养时间对C-18菌株产抗生素有较大影响,培养4d时发酵液已具有抑菌活性,但活性不高。随着培养时间的延长抑菌活性逐渐提高,培养至7.5d时发酵液的抑菌活性达到最大,此后发酵液的抑菌活性有所下降。所以C-18产抗生素的最佳发酵时间为7.5d。
2.6 正交组合试验结果
根据以上单因素试验结果,取pH、温度、装液量、培养时间四因素和相应的三个水平值,按四因素三水平正交组合设计方案进行发酵培养,测发酵液的抑菌活性,结果见表3。
通过试验可知发酵培养基的初始pH为7.5、培养温度为
|
表3 四因素三水平正交组合试验结果 | ||||
|
实验方案 |
处理菌落半径 |
对照半径 |
拮抗带 |
相对抑菌率 |
|
(mm) |
(mm) |
(mm) |
(%) | |
|
实验1、pH7.5, |
2.9 |
17.0 |
14.1 |
82.9 |
|
实验2、pH7.5, |
2.2 |
17.0 |
14.8 |
87.1 |
|
实验3、pH7.5, |
2.7 |
17.0 |
14.3 |
84.1 |
|
实验4、pH8.0, |
3.2 |
17.0 |
13.8 |
81.2 |
|
实验5、pH8.0, |
2.8 |
17.0 |
14.2 |
83.5 |
|
实验6、pH8.0, |
3.6 |
17.0 |
13.4 |
78.8 |
|
实验7、pH8.5, |
4.6 |
17.0 |
12.4 |
72.9 |
|
实验8、pH8.5, |
4.3 |
17.0 |
12.7 |
74.7 |
|
实验9、pH8.5, |
4.2 |
17.0 |
12.8 |
75.3 |
|
实验10、pH7.5, |
2.4 |
17.0 |
14.6 |
85.9 |
|
实验11、pH7.5, |
2.6 |
17.0 |
14.4 |
84.7 |
|
实验12、pH7.5, |
2.5 |
17.0 |
14.5 |
85.3 |
|
实验13、pH8.0, |
3.0 |
17.0 |
14.0 |
82.4 |
|
实验14、pH8.0, |
3.4 |
17.0 |
13.6 |
80.0 |
|
实验15、PH8.0, |
3.3 |
17.0 |
13.7 |
80.6 |
|
实验16、pH8.5, |
4.5 |
17.0 |
12.5 |
73.5 |
|
实验17、pH8.5, |
4.0 |
17.0 |
13.0 |
76.5 |
|
实验18、pH8.5, |
4.8 |
17.0 |
12.2 |
71.8 |
2.7 发酵液稳定性分析结果
将原始发酵浓缩液在
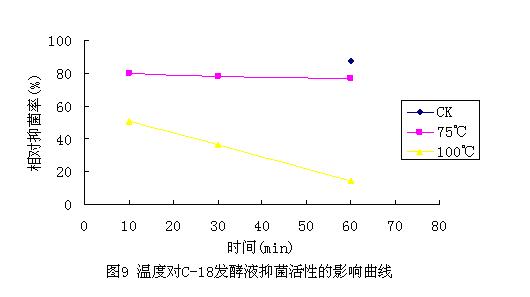
在相同测试条件下,将各处理发酵液分别进行抑菌活性测定,结果见图10。
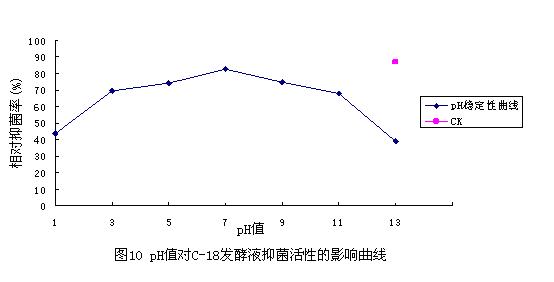
从图中可以看出,在极酸和极碱(pH值小于3、大于11)条件下,发酵液的抑菌活性下降;而在中性和酸碱条件下(3<pH<11),抑菌活性都很稳定,与对照相差不大,说明发酵液的酸碱稳定性较好。
3 讨论
一般工业发酵工艺的研究分为三个阶段,实验室阶段、中试工厂规模、工厂生产规模。生产中广泛采用摇瓶试验进行初步考察,再逐步转移到工厂生产中去,即新工艺的放大,摇瓶试验的结果为罐发酵试验提供一些可供参考的数据,具有一定的指导意义,但摇瓶发酵放大到发酵罐发酵时往往两者结果并不一致。本试验的结果是在实验室进行的,真正应用到生产上还要进一步中试放大,进而进行大规模的生产[8]。
致谢 广西大学生命科学与技术学院陈山岭和管立忠等同学在实验过程中给予了很多帮助,特此致谢。
参考文献
[1]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册.北京:科学出版社,1975,658
[2]祖若夫,胡宝龙,周德庆.微生物学实验教程[M].上海:复旦大学出版社,1993:177-180
[3]中国医药工业总公司,抗生素工业生产编写组. 抗生素工业生产(上、下册);1986
[4] 张宇, 张敏, 叶亚军. 稻瘟病生防放线菌菌株A11发酵液中抗菌物质的稳定性测定[J]. 中国农学通报. 2005, 21(6):315-316.
[5]孟庆芳,张汀,杨文香. 拮抗链霉菌S23发酵条件的研究.中国生物防治,2002,18(2):79-82
[6]何红,沈兆昌,邱思鑫.内生拮抗枯草芽孢杆菌BS22菌株的发酵条件.中国生物防治,2004,20(1):38-41
[7]韩斯琴,徐梅,白震.番茄灰霉病菌拮抗菌D2-4发酵条件的研究.东北农业大学学报,2004,35(1):93-98
[8]张嗣良,梁学贤. 我国生物及制药过程控制与装备技术的发展趋势与今后发展设想. 医药工程设计杂志, 2002,23(1):3-4
上一篇:小多孢菌次级代谢产物的研究
下一篇:从抗生素到微生物药物
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

