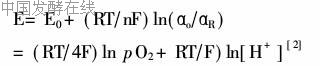控制发酵过程氧化还原电位优化酿酒酵母乙醇生产
2007-10-29 22:32:46 来源:生 物 工 程 学 报 评论:0 点击:
氧化还原电位(ORP)是指水溶液或培养基中可得到或失去的自由电子,一般以毫伏(mV)为单位,可以为正值也可以为负值。ORP值越高说明溶液的氧化水平越高,相对容易失去电子,反之亦然。在微生物的发酵过程中,发酵液一般来说并不处于氧化还原平衡的状态。这是因为微生物细胞吸收培养基中的营养成分,通过内部的氧化还原反应与其胞内的代谢过程相连来获取能量用于生长,维持和产物的合成。在培养过程对氧化电位进行检测
具有非常重要的生物学意义。它可以:(1)给操作人员提供必要的信息以保证微生物生长在合适的氧化还原环境下;(2)在厌氧条件下测定溶氧电极检测限之外的痕量氧值;(3)在生物工程下游技术中,监测
ORP值可以提供某种化学物质是否存在或化学物质之间转换的证据;(4)一定的ORP值是蛋白质正确折叠,尤其是二硫键形成的关键因素。Yun-Huin Lin等[1]利用氧化还原电极监测克拉维酸的生产过程,发现ORP对克拉维酸的生成有着比溶氧更好的关联性,利用氧化还原电极进行调控将克拉维酸的产量提高了96%。
在微生物培养过程中,氧化还原电极所测的电位反映了进行最快的氧化还原电对,因此可以利用该电极对正在变化的化学物质的相对浓度进行检测。由于培养基中O2/H2O氧化还原电对的氧化性要远大于培养基中存在的其他物质,因此即使培养基中仅仅含有痕量氧,也可以在氧化还原电极上产生信号。所以,可以用氧化还原电极检测痕量的溶氧,得到溶氧电极检测限之外的测量值。ORP电极的检测原理是基于溶液中的金属电极上进行的电子
交换达到平衡时具有的氧化还原电位(ORP)值,此值与溶氧、pH和温度有关:
其中E0:标准氧化还原电位值;αo:氧化型物质的活度;αR:还原型物质的活度;pO2:溶液中溶氧平衡的氧分压。
由上式可以看出若控制好发酵液的温度和pH值,氧化还原电位值就仅仅与溶氧相关。本文利用这一特点,研究了在乙醇发酵过程中控制氧化还原电位ORP对乙醇生产过程的影响。
1 材料与方法
1·1 实验设备与材料
菌种:Saccharomyces cerevisiaeB1(本实验室驯化保藏)。
种子培养基:葡萄糖4%、KH2PO41%、MgSO40·05%、yeast extract 0·5%、CaCl20·01%、(NH4)2SO40·5%,初始pH5·5。发酵培养基:葡萄糖28·6%、其他营养成分与种子培养基一样,pH5·0。培养装置:5L生物反应器,配置温度电极,pH电极和氧化还原电位电极(Mettler 2100e,瑞士)及无菌空气进出系统和循环冷却水系统。
1·2 试验方法
种子培养:挑取一个平板菌落,接入装有30mL种子培养基的250mL摇瓶中,30℃培养18h,然后将摇瓶种子接入装有1500mL种子培养基的5L生物反应器中,接种量为6%,用12%的NaOH控制pH在5·0,ORP(氧化还原电位)大于60mV,30℃培养约22h。
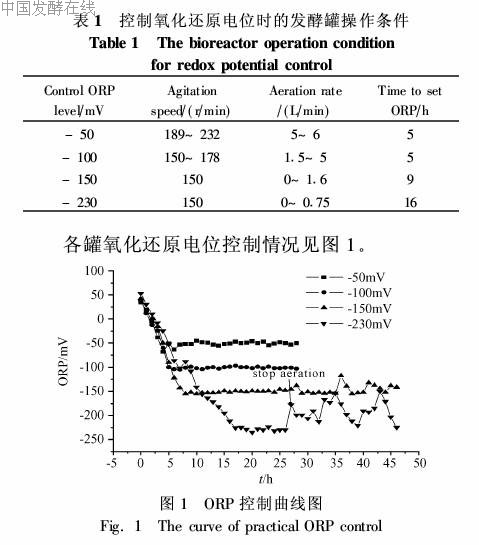
发酵培养:本试验采用种子培养与发酵培养在同一个生物反应器中完成的方式。当上述5L生物反应器中的菌浓达到(2±0·3)×108个/mL时(此时种子培养基中的葡萄糖已经用完),加入补料葡萄糖使葡萄糖浓度达到28·6%±0·5%(W/V)。然后停止通气,调转速到150r/min,待ORP值降到试验设定值时,通过控制转速和通气量使氧化还原电位分别维持在-50mV、-100mV、-150mV、-230mV,来研究氧化还原电位对发酵过程的影响。发酵过程中用工业氨水控制pH为5·0,温度为30℃。控制氧化还原电位时的发酵罐操作条件如表1。
1·3 测定方法
生物量测定:取发酵液10mL,7500r/min(6280g离心洗涤3次,烘干至恒重。乙醇测定:使用装备氢火焰离子检测器的气相色谱仪GC920及CMDC气相色谱工作站,用甲醇做内标,色谱条件:气化室温度:145℃柱炉温度100℃监测器温度155℃,以N2作为载气,载气流量0·18MPa。葡萄糖浓度测定:利用葡萄糖试剂盒。酿酒酵母死亡率测定:流式细胞仪法[3,4]。流式细胞仪测定死亡率标准图谱的建立:在好氧生长条件下,分别取1mL处于对数生长期(在接种后8h)的酿酒酵母细胞置于两支10mL离心管中,再分别用0·1mol/L的PBS溶液[3]稀释至细胞浓度约为(1~5)×106个/mL。将其中一支稀释液作为全活对照,另一支放在沸水浴中水浴15min将细胞全部煮死作为全死对照,然后各取5mL全死对照和全活对照等体积混合作为死活均半对照。取全活对照(图2b)、全死对照(图2a)和死活均半对照(图2c)各1·5mL,分别加入10μL PI(碘化丙锭,sigma 1mg/mL)染色,利用BD流式细胞仪FACS Calibur (BectonDickinson, Franklin Lakes, NJ, USA)进行死亡率分析。结果如图2所示: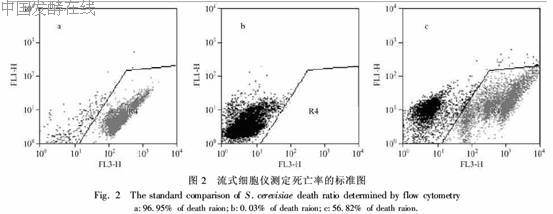
甘油含量测定:甘油三酯试剂盒。有机酸测定[5]:取10mL发酵液,7500r/min 4℃离心10min,取1·5mL上清液4℃12000r/min (16090g)离心15min,再取上清液用0·22μm的膜过滤,滤液于-20℃保存待用。采用HPLC法测定发酵液中的有机酸,色谱柱为AquaSep公司C8(5μm,4·6mm×25cm),采用0·01mol/L磷酸水溶液(用NaH2PO,调节pH至2·32)作为流动相,流速0·6mL/min,进样量20μL,柱温30℃,检测波长210nm。
2 结果与讨论
2·1 不同氧化还原电位下的糖醇转换率
由表2可以看出在不同的ORP值下,生物量与糖醇转化率皆有较大的差异。在试验范围内,ORP值越低,糖醇转化率越高,生物量越小。这说明微量溶氧对酿酒酵母代谢流的分配有较大的影响,但这种影响是如何作用于酿酒酵母代谢本身的,对发酵过程中酵母细胞的副产物生成和酵母细胞活性有何影响,我们通过连续监测酿酒酵母酒精发酵的主要副产物甘油及酵母死亡率和有机酸的变化,对酒精发酵代谢规律进行了研究。由ORP控制曲线可知,
在发酵过程中到达各设定ORP所需的时间并不相同(表1),因此下文在分析代谢过程的时候主要关注的是各设定ORP达到稳态后(表1)的代谢差别。
2·2 不同氧化还原电位下的酒精发酵过程分析
2·2·1 控制不同的ORP对酵母细胞生长与乙醇生产的影响:不同的ORP值对酿酒酵母细胞生长和乙醇生产的影响如图3b、图3a所示。由图3b中可知,ORP值越高,酿酒酵母的最终细胞浓度越大。当ORP值控制在-50mV和-100mV时,其最高生物量分别达到了31·1g/L和24·7g/L,远远大于ORP值为-150mV和-230mV时的16·7g/L与12·0g/L。而对应的乙醇生产情况则刚好相反(图3a),当ORP值为-150mV和-230mV时的乙醇产量达到了16·13%和15·4%(V/V),约为ORP值为-50mV和-100mV时的1·7~2倍。我们比较了不同的ORP下比生长速率(μ)和比乙醇生成速率(qethanol)之间的关系(图4),由图4可见,当控制的ORP值达到稳定状态之后,各ORP之下的比生长速率(图4b)和比乙醇生成速率(图4a)都呈下降趋势,将ORP维持在-50mV和-100mV与ORP为-150mV和-230mV时相比较,其比生长速率(μ)较大而比乙醇生成速率(qethanol)较小。从图4还可以看出,在整个发酵期间,ORP值为-150mV和-230mV时,整个发酵期间的比乙醇生成速率(qethanol)下降幅度明显比ORP为-50mV和-100mV时的降幅小。由于控制不同的ORP值主要影响的是发酵液中的溶氧水平,而溶氧水平对酿酒酵母乙醇生产而言有利有弊:一方面微量的溶氧是酿酒酵母保持细胞活性,提高对乙醇的耐受性所必须的[6];而另一方面如果溶氧水平过高则氧会抑制糖酵解途径的活性[7],取代乙醛作为电子受体直接减少乙醇合成的前体物质,生长大量菌体,浪费碳源,降低乙醇得率。因此,当ORP值维持在-150mV和-230mV时,乙醇途径是主要的产能途径,所以qethanol在整个发酵期间幅较小;而在ORP值维持在-50mV和-100mV时,由于菌体产能对乙醇途径的依赖性减弱所以qethanol降幅较大。ORP值越低乙醇的得率系数越高(表2),说明厌氧程度越深乙醇途径的效率越大。当ORP值为-230mV时,其得率系数YP/S(W/W)最高(0·47),但其乙醇浓度较ORP值为-150mV时低,究其原因是残糖浓度达到了3·2%(W/W),而残糖浓度高对工业生产而言是不能容忍的。因此,综合得率系数、最终的乙醇浓度和残糖,我们得出控制ORP值在-150mV是极为有利的。所以,对酒精生产而言,控制发酵液中的溶氧水平是必须的,但传统的溶氧电极无法在较低溶氧值的情况下读数,因此无法对厌氧发酵过程进行监测,而氧化还原电极给我们提供了一个新的精细监手段,可以对厌氧程度进行定量。
2·2·2 控制不同的ORP水平对甘油生成的影响:甘油是乙醇发酵的主要副产物。据相关文献报道[8],甘油生成主要起两个作用:其一,是酿酒酵母抵御外界高渗透压的手段;其二,维持胞内的氧化还原电位平衡。由图3d可以看出,甘油产量在不同的ORP条件下有明显的差异,ORP值越高,甘油产量越大。比较图3d和图3b可以看出,甘油和生物量着非常好的正向对应关系,生物量越大,甘油产量越高。造成这种现象的原因可能是高ORP值下的有氧呼吸途径仍然具有较强的活性,细胞生长旺盛,产生较多的NADH。一般来说在厌氧情况下对NADH进行重新氧化的唯一途径是通过甘油途径,但在有氧存在的情况下,由于细胞合成所积累的NADH则可以通过多种途径重新氧化[10]。我们注意到,当ORP控制在-150mV时的甘油曲线与生物量曲线(图3d、图3b)的分离度较大。对造成这种现象的原因目前还不清楚,一个可能的解释是,当ORP值较高时(-50mV、-100mV),由于溶氧较多,产生的NADH中有一部分被氧氧化而不是通过甘油途径氧化,所以甘油产量相对于NADH全部由甘油途径氧化时低;而当ORP为-150mV时,由于溶氧相对较少,NADH全由甘油途径重新氧化,因此单位菌体的甘油产量也较大,与生物量的偏离量也较大。从图3d我们还可以看到,当ORP为-150mV和-230mV时28h后的比甘油生成速率都呈上升趋
势,这可能是因为随着乙醇的积累渗透压变大,细胞通过甘油途径来抵抗渗透压的增加所致。
因此,由溶氧差异带来的酿酒酵母细胞的代谢、细胞活性及所处环境的氧化还原状态的差异对甘油的生成有着重要的影响,所以精确控制微量溶氧的水平能在酿酒酵母乙醇发酵和甘油生成中间找到一个合理的平衡点。
2·2·3 不同ORP水平下的有机酸分泌情况:本实
验通过定时取样,分析了酿酒酵母分泌到发酵液中的有机酸变化情况。试验结果表明(图5),在各氧化还原电位下丙酮酸的分泌(图5a)在菌体死亡率不断下降期间(图3e),都以基本恒定的速率向外分泌,且ORP值越高分泌量越多,而当亡率开始上升之后单位菌体的分泌量逐渐减小。这说明死亡率可以表征酿酒酵母的代谢活性,当酿酒酵母活性较强时,糖酵解途径比较活跃,导致了丙酮酸的大量产生和分泌。丙酮酸脱羧酶是乙醇途径的一个关键酶,据Jack T.Pronk等报道[12],丙酮酸脱羧酶的活性与丙酮酸的含量有着密切的正协同效应。所以丙酮酸的含量越高对乙醇途径越有利,但我们的试验结果却表明尽管ORP为-50mV和-100mV时的丙酮酸含量在16h前比-150mV和-230mV时高,但乙醇的生成却没有表现出优势来,所以,相对于丙酮酸来说可能溶氧对乙醇途径的活性影响更大。由图5b可以看出,各ORP条件下,琥珀酸的变化趋势基本一样,但ORP值越低,其琥珀酸的相对含量也较高。据相关文献报道,琥珀酸可以作为一种维持细胞氧化还原平衡的重要代谢物[11],这说明低ORP值能加剧胞内的氧化还原水平的失衡,所以细胞需要产生更多的琥珀酸。由图5c和图5d可以看出,在整个发酵过程中柠檬酸和α-酮戊二酸在发酵前期(16h前)基本都呈下降趋势,而在发酵后期基本维持不变或略有上升。参考ORP控制曲线(图1)可以发现,即使设定ORP为-50mV,但其稳定控制是从5h后开始的。所以,造成这种现象的原因可能是在发酵开始前期,由于种子培养时的好氧生长,发酵液中已经积累了一定量的柠檬酸(图5c),并且发酵液中的溶解氧并未完全用完,而一定的溶氧也正好有利于柠檬酸的生成[13],所以前期(0~4h)柠檬酸含量较高。柠檬酸和α-酮戊二酸作为三羧酸循环的中间代谢物,在厌氧条件下随着菌体的生长其消耗逐渐加大而生成量减少,所以单位菌体分泌出的量逐渐减小,在20h后,其产量也基本稳定。据MarinaKarelina Nielsen等[14]报道,在厌氧条件下,柠檬酸的存在会削弱乙醇途径的活性而加强甘油途径的活性并且会螯合发酵液中的钙、镁离子,削弱糖酵解途径中的某些关键酶(如丙酮酸脱氢酶)和ATP合成酶的活性,因此在菌体生长阶段,提供充足的溶氧防止柠檬酸在发酵液中的积累对乙醇发酵是必要的。由图5我们还可以看出ORP值越高,生成的有机酸的重新利用情况就越好,这可能是因为有机酸的积累对酿酒酵母是有毒性的[15],而溶氧水平越高酿酒酵母对这种毒害的抵抗力就越强,所以有机酸的重新利用情况就比较好。
2·2·4 控制不同的ORP对糖耗的影响:对酒精发酵而言,葡萄糖主要用于产乙醇、生长菌体和甘油生成,只有少量葡萄糖用于其他副产物的形成。由糖耗曲线可知(图3c),ORP值越高糖耗速率越快。当ORP控制在-50mV和-100mV时,24h即可将糖耗完,而ORP控制在-230mV时,到46h仍有3·2%的残糖。由图3c可知,ORP值越低后期降糖越缓慢,而后期降糖缓慢是影响乙醇发酵指数的重要因素,提高糖耗速率就可以进一步减少乙醇发酵的周期从而节约发酵成本。影响糖耗的因素很多(如糖的运输、有害代谢物的积累),但都可以归结为菌体活力的影响。在本试验中,以用流式细胞仪测得的酵母死亡率为依据对不同ORP下酿酒酵母的活性变化进行了考察。
2·2·5 不同ORP控制对酿酒酵母细胞活性的影响:在乙醇发酵中影响细胞死亡的因素有溶氧、乙醇、甘油和有机酸等。这些因素环环相扣,互相影响。例如:乙醇的积累对酵母细胞具有毒性,不饱和脂肪酸有助于提高细胞对乙醇毒性的耐受性,而溶氧水平的高低又会影响不饱和脂肪酸的合成[16,17];
但高溶氧水平却又会降低乙醇途径的效率;甘油有助于抵抗高渗透压和维持氧化还原平衡,但过量的甘油生成会降低乙醇得率;有机酸(如琥珀酸)的生成在某种程度上可以帮助酿酒酵母抵御不良环境,但当其和乙醇一起积累时又会进一步加剧乙醇的毒性。由图3e可知,在开始补糖后的4h内,死亡率迅速上升,这有可能是因为酿酒酵母从耗氧生长转到厌氧的同时受到较高糖浓度的胁迫,需要一定时间来适应。在4h之后,可能是适应了的酿酒酵母已经调整好了自身的代谢状况开始生长,所以死亡率开始下降,生物量和乙醇生产速率开始上升,甘油含量也逐步增加。20h后,死亡率再一次上升,且ORP值越小,上升幅度越大,当ORP值为- 150mV和-230mV时,35h后的死亡率达到了20%以上,均高于ORP为-50mV和-100mV时。这种死亡率的急剧上升可能是由于乙醇的积累造成的。因为在20h后,比较可能对细胞造成毒性的物质:乙醇和有机酸,只有乙醇的浓度在不断上升,有机酸含量都有不同程度的下降,且ORP为-230mV时的降糖速率明显比-150mV时慢。因此,这有可能是在低ORP的情况下,酵母细胞对乙醇的耐受性下降。可见,控制不同的ORP对于酿酒酵母的活性有重要的影响,对增强乙醇生产和降低残糖浓度具有重要作用,这对燃料乙醇工业而言具有重要意义。
3 结论
(1)根据乙醇、甘油、生物量、死亡率和有机酸的代谢变化曲线我们可以看出不同的ORP下,酿酒酵母有不同的代谢流分配方式。所以通过氧化还原电极我们可以非常方便的进行乙醇发酵的反应器操作,以便有效地降低副产物生成、维持酵母活性、提高乙醇产率和降低残糖。
(2)ORP值较高(-50mV、-100mV)的情况下,乙醇的生产效率极低,而ORP太低则死亡率大幅增加,酵母活性降低导致后期无法降糖,因此必须根据实际情况设定一个合理的ORP操控值。
(3)在ORP值较低(-150mV、-230mV)的情况
下,根据死亡率变化曲线,在菌体死亡率在20h降到最低并且准备开始上升时,增加通气量有可能使菌体在低死亡率维持较长的一段时间,从而减少发酵周期,提高乙醇得率,并有可能耐受更高浓度的初糖。
(4)在本次试验范围内,控制ORP为-150mV对乙醇生产较为有利。
相关热词搜索:乙醇
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)