大肠杆菌发酵生产重组人颗粒溶素
2007-10-26 19:33:28 来源:江苏大学 评论:0 点击:
颗粒溶素(granulysin,GNLY)是存在于人类细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK cells)胞浆颗粒中的细胞毒性蛋白【l_ ,具有广谱抗菌活性【引。在机体免疫应答过程中,GNLY与穿孔素和颗粒酶等颗粒成分一起排出胞外,参与抗菌、抗病毒、抗寄生虫及杀伤肿瘤细胞等免疫过程M 。迄今,GNLY是细胞毒颗粒中惟一能直接杀伤细菌的免疫效应分子, 因此GNLY具有潜在的药用价值。近年来国外虽然有少数实验室将GNLY基因克隆到原核表达系统中,得到重组人GNLY,但尚未见有关工程菌发酵条件优化的报道。本实验室在国内首次获得了有生物活性的重组GNLY蛋白,并在此基础上对其工程菌的发酵条件进行了优化,为进一步研究GNLY的作用机制和临床应用打下基础。
1 材料与方法
1.1 材料
大肠杆菌BL21(DE3)plysS为本科保存株;重组质粒pET28a(+)一GNLY由本实验室构建。
试管种子培养采用LB培养基(蛋白胨10 g/L,酵母粉5 g/L,NaC1 10 g/L), 二级种子培养采用2xYT培养基(蛋白胨16g/L,酵母粉10 g/L,NaC1 5 g/L)。发酵罐基础培养基为半合成培养基[蛋白胨10 g/L,酵母粉10 g/L,KH2PO 2 g/IJ,K2HPO4 g/IJ,Na2HPO~·12H20 7 g/L,(N}{4)2SO4 1.2 g/L,NH4C1 0-2 g/L,MnSO4·5H20 0.001 g/IJ,CoC12·6H20 0.004 g/IJ,Na2MoO4’2H20 0.002 g/IJ,ZnC12 0.002 g/L,CuSO4·5H20 0.001 g/IJ,H3BO4 0.005 g/IJ,FeSO4·7H20 0.02 g/IJ,CaC12’2H20 0.02 g/IJ,MgSO ·7H20 0.3 g/L,去泡剂0-2 mL/L]。补料培养基(甘油160 g/L,酵母粉65 g/L,蛋白胨65 g/L,MgS04’7H20 5.7 g/L)。各培养基均为pH7.0,并加入卡那霉素至终浓度25 I~g/mL。
蛋白胨,酵母粉均为OXIOD公司产品;层析纯化His-BindResin为Novagen公司产品。
FUS一50L生物反应器(上海国强生化工程装备有限公司)含pH 控制器、溶氧控制器、温度控制器、搅拌控制器、空气混合器及补料进样系统等。
1-2 细菌培养
待基础培养基组分(蛋白胨、酵母粉)溶解后,加入发酵罐,121oC灭菌30 rain。冷却后加入经同样条件灭菌的KH2P04、K2HP04、Na2HP04·12H20、(NH )2SO 、NH C1、微量元素溶液和去泡剂及卡那霉素。待补料培养基组分(蛋白胨和酵母粉)溶解后,121oC灭菌30 rain,与经同样条件灭菌的甘油和MgS0 ·7H20冷却后混合并加入卡那霉素。培养基各溶液在灭菌前都用NaOH调节到适当的pH值。将构建的重组质粒转化宿主菌BL21(DE3)plysS,挑取单克隆接种于LB液体培养基中,37oC、250 r/rain振荡过夜,作为活化的一级种子。取一级种子液, 以5%的接种量转接于含100mL 2xYT培养基的50o mL摇瓶中,37oC、250 r/rain振荡5 h,作为接人发酵罐的二级种液。按发酵罐工作体积的5%接人二级种子液,接种后发酵液体积为30 L。发酵培养分3阶段进行,起始4 h为细菌在基础培养基中生长,4 h后开始加入补料,继续生长6 h后开始进入第3个阶段,加入葡萄糖,温度降至30℃ ,在继续补料的情况下诱导表达。在诱导后1-6 h内间隔1 h取样测表达率;根据溶氧变化反馈补料,在整个发酵过程中,要根据pH值变化补加30%的氨水,维持培养体系pH值为6.5~7.0;调控搅拌速度及空气流量,使溶氧不低于30%,必要时通纯氧。
1.3 细菌生长情况监测
在发酵过程中每0.5 h测定1次菌液浓度(D‰ 值);发酵结束后,将发酵菌液以5 000 r/rain于4℃离心30 rain,PBS重悬菌体2次,称量菌体湿重。
1.4 表达上清中可溶性GNLY的纯化
加入10倍体积的lxPBS,置冰浴中以30o~400 W 超声裂解15次,每次10 s,间隔10 s,重复1次。离心取上清,用Novagen公司的His—Bind Resin以亲和层析法纯化GNLY融合蛋白,以不同浓度的咪唑平衡洗脱GNLY。
1.5 GNLY融合蛋白最佳诱导时间的筛选
取诱导表达1、2、3、4、5、6 h及过夜菌各1 mL,用SDSPAGE检测比较不同诱导时间所得GNIJY蛋白的量,筛选最佳诱导时间。
1.6 重组蛋白表达量的测定
取纯化所用蛋白及变性裂解所得到的细菌总蛋白,按一定稀释度用Beckman DU640微量核酸蛋白检测仪测定D 值,初步估算其纯度及浓度,计算表达率。比较发酵罐、摇瓶以及诱导1-6 h内的蛋白表达量。
1.7 Western 印迹验证重组蛋白的抗原活性
重组蛋白经SDS—PAGE后进行转印,将转印后的NC膜剪成条带,用含5%脱脂奶粉、0.02% Tween一20的PBS封闭过夜。依次加入兔抗6一His多抗、羊抗兔IgG抗体、3,3一二氧联苯胺底物,检测重组蛋白的抗原性。
1.8 融合蛋白生物活性的检测
取大肠杆菌和不同浓度的GNLY共50 L于37℃共孵育3h,样品被稀释扩散于胰酶解酪蛋白琼脂,24 h后检测CFU数。
2 结果
2.1 补料培养细菌生长情况
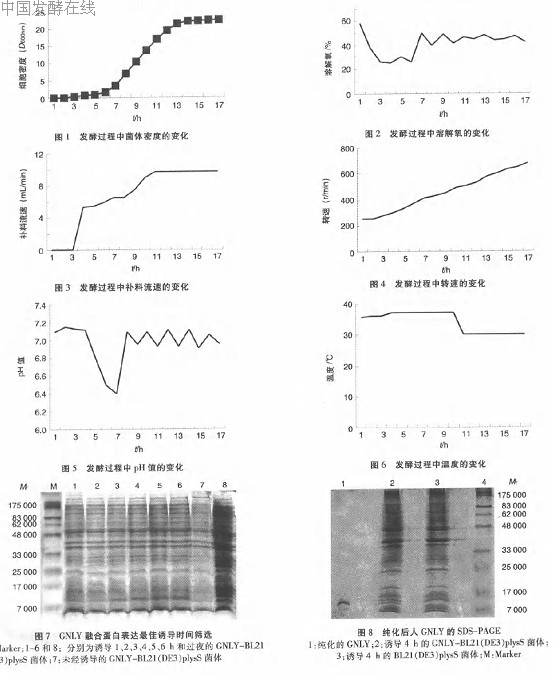
在50L发酵罐中,我们分别在细菌生长到第8、9、10、11、12、13 h时开始诱导表达,发现在第8、9 h开始诱导表达时细菌最终密度较小( 值分别为17和19.5),第11 h开始诱导时细菌最终密度已达最大(D 值为22.6),继续延长开始诱导的时间到第13 h,菌体最终密度变化不大,说明在第11 h已经到达细菌生长的平台期。对发酵总时间、补料开始时间、诱导时机及诱导时间进行优化后,发现本方法培养17 h菌体密度最大可达到D 值为22.6,相当于80 g/L细菌湿重。
当细菌生长4 h后,溶氧下降速度明显减慢,表明培养基中营养物质已被消耗,细菌生长速度开始下降,故耗氧减少,应该开始补料。补料流速应控制在一定范围内,至11 h达最大,为9.8 mL/min,为维持pH值为6.5~7.1、溶氧30% 以上,在第7 h开始补加30%的氨水,转速从第1 h的250 r/rain随着时间依次递增至最后为680 r/rain。在发酵过程中菌体密度、溶氧、补料流速、转速、pH值和温度的变化见图1~图6。
2.2 GNLY融合蛋白表达最佳诱导时间的确定
重组原核表达质粒pET28a (+)一GNLY在大肠杆菌BL21(DE3)plysS中经IPTG诱导表达,1~2 h时蛋白表达量逐渐增加,4~5 h时蛋白表达量达到最大;培养时间再延长,蛋白表达量无明显变化;诱导过夜,蛋白表达量反而降低。见图7。
2.3 可溶性GNLY的表达及纯化
发酵结束后将收获的细菌反复超声15次以后,离心取上清,用亲和层析法纯化。经扫描显示,纯化所得的GNLY融合蛋白占细菌总蛋白的5%。12% SDS—PAGE显示在相对分子质量为9 000处有明显的蛋白条带。经该法纯化后的蛋白纯度可达95%以上。见图8。
2.4 蛋白表达率的计算
利用His—Bind Resin亲和层析纯化上清中的GNLY,用核酸及蛋白分析仪测定其D~ 值,计算所纯化蛋白的纯度及浓度,最终得到蛋白得率为0.63 mg/g湿菌,故发酵后所获可溶性蛋白量为60 m 菌液。用同样方法测定未纯化前细菌的总蛋白,计算出可溶性GNIJY约占菌体总蛋白的5%,包涵体中融合蛋白的表达量占菌体总蛋白的65%。比较发酵罐培养诱导表达1-6 b后蛋白的表达率,发现诱导后1~3 h为高表达期,诱导后5-6 h表达蛋白变化不大且已达到最大表达量(图9)。
2.5 GNLY融合蛋白的免疫学活性测定
亲和层析后将含GNLY融合蛋白的洗脱组分进行SDS—PAGE,再行免疫印迹检测,结果表明在相对分子质量9 000处有明显的抗原抗体反应(图10)。
相关热词搜索:大肠杆菌
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)