巴斯德毕赤酵母表达的突变型人白细胞介素_2的发酵条件与纯化研究
2007-05-17 21:56:45 来源:生 物 工 程 学 报 评论:0 点击:
白细胞介素_2(IL 2)是免疫调节中起核心作用的一种疏水蛋白质,分子量为15kD;其各种生物学活性包括促进T淋巴细胞增殖以及增强自然杀伤细胞的活性[1]。它有一对二硫键(Cys58 Cys105)和一个自由的125位半胱氨酸。白细胞介素_2(IL 2)通常用大肠杆菌E.coli作为宿主进行表达纯化[2]。在以往的文献[3]报道中,重组IL_2经变性剂6mol L盐酸胍(GuHCl)抽提变性;重新折叠 氧化复性后才能从E.coli中纯化并达到分析规模。在这些研究中重组IL 2的纯化最大不超过5mg L的水平,因此大肠杆菌E.coli制备IL 2有一定的局限性。另外大肠杆菌E.coli是一种原核表达系统,而巴斯德毕赤酵母表达系统作为真核表达系统,具有许多其它蛋白表达系统所不具备的优点[4]。本文在构建突变型人白细胞介素_2基因并在巴斯德毕赤酵母中初步表达[5]的基础上,进一步优化发酵条件,首次从毕赤酵母表达分泌上清液中纯化出分泌的突变型人白细胞介素_2。纯化步骤简单可行,适合工业化生产,每升大约可得白细胞介素50mg左右。所获得的突变型IL 2纯品比活性为4 0×107IU mg蛋白,比天然型IL 2高5倍左右,可望作为一类新药作进一步的研究。
1 材料与方法
1 1材料
1 1 1 菌株与质粒:宿主菌为毕赤酵母菌株KM71,表达质粒为携带有人突变型或野生型白细胞介素_2(IL_2)的pPIC9K,由本室构建完成,保存于-70℃,15%甘油中。1 1 2 试剂:蛋白胨(bacto_tryptone)和酵母粉(bacto_yeastextract)均为OXOID公司产品,丙烯酰胺(Acrylamide)、N,N_甲叉双丙烯酰胺(N,N_Methylene_Bis_Acrylamide)及考马斯亮蓝R250为Sigma公司产品,蛋白标准品(middlerange)为BIO_RAD公司产品,苯甲基磺酰氟(PMSF)为NORTH_BIO公司产品,强酸性阳离子交换剂( SO2-3)及强碱性阴离子交换剂( N+(CH3)3)为BIO RAD公司产品,葡聚糖凝胶(SephadexG_100)为Pharmacia公司产品,其余为国产分析纯试剂。1 1 3 培养基:LB;LA;RDB(%):山梨醇1mol L,葡萄糖1,YNB1 34,生物素4×10-5,氨基酸0 005(L_谷氨酸,L_蛋氨酸,L_赖氨酸,L_异亮氨酸);YPD(%):蛋白胨2,酵母提取物1,葡萄糖2;BMGY(%):YNB1 34,蛋白胨2,酵母提取物1,生物素4×10-5,甘油1100mmol L磷酸缓冲液(pH6 0)配制;BMMY(%):YNB1 34,蛋白胨2,酵母提取物1,生物素4×10-5,甲醇0 5~3,100mmol L磷酸缓冲液(pH6 0)配制。1 1 4 主要仪器设备:超速冷冻离心机(SorvallRC28S)为DUPONT公司产品,紫外 可见分光光度计(6010)为上海惠普分析仪器厂产品,电泳仪(MiniPROTEAN3cell)为Bio Rad公司产品,超滤浓缩系统(Labscale)为美国Millipore公司产品,真空冷冻干燥仪为美国FTSSYSTEMS公司产品,蛋白纯化系统(BiologicalLP)为Bio_Rad公司产品。
1 2 方法
1 2 1 工程菌的发酵[6]及条件的优化:将保存的突变型和野生型IL_2工程菌[5]分别接种于2mLYPD培养基中,过夜培养,以1%接种入含100mLBMGY的500mL三角瓶。30℃300r min培养至OD600=3~6(大约16~18h)。弃上清液并将菌体细胞沉淀悬浮在1 5或1 10倍原初始培养液体积的BMMY培养基中,每隔24小时加入甲醇使其终浓度分别为0 5%到5%进行诱导。优化发酵条件:通气状况、诱导时间、初始pH值等。一旦最佳条件确定,则可以按比例放大,从摇瓶培养转至大规模发酵。1 2 2 人重组白介素_2(rhIL_2)粗提液的获得及超滤浓缩:甲醇诱导2d后,4℃,15000r min离心10min,上清液立即加入PMSF(丝氨酸蛋白酶的抑制剂)至1mmol L或者5~10mmol LEDTANa2,防止蛋白酶的作用。上清液用0 45μm膜过滤得到rhIL_2粗提液200mL,用MW=30000的膜截流,加双蒸水(相当于5个体积的发酵液),循环滤过,最后弃去杯中浓缩液(很少),除去MW大于30000的杂质。收集过滤液(含有IL_2)。再用MW=10000的膜截流,加50mmol L乙酸_乙酸钠缓冲液(pH3 5)约5~10个体积(将杯内的滤过液替换成缓冲液),浓缩成约200mL(或更少),除去MW小于10000的杂质并浓缩。1 2 3 强阳离子交换S柱离子交换色谱:强酸性阳离子交换树脂(Bio_Rad公司Macro_PrepSSupport,作用基团:_SO-3),柱体大小:2 5cm×30cm,以pH3 5,含50mmol L乙酸_乙酸钠缓冲液(工作液)充分平衡,rhIL_2粗提液上柱,用工作液淋洗至无蛋白流出,再用含0~1mol LNaCl的工作液进行洗脱,流速10mL h,收集各峰,测定蛋白质含量,电泳以确定目标蛋白的洗脱组分,收集rhIL_2纯度较高的组分。1 2 4 SephadexG_100凝胶过滤色谱:SephadexG_100凝胶柱(1 5cm×80cm)以pH7 0,含5mmol LEDTANa2,2mmol L巯基乙醇的0 1mol LNH4Ac缓冲液充分平衡,将1 2 3收集到的含rhIL_2的组分经脱盐,冷冻干燥后溶于少量pH7 0(0 1mol L)乙酸铵缓冲液后上样,用上述平衡液进行洗脱,流速20mL h,收集各峰,测定蛋白质含量并作电泳分析。1 2 5 纯度鉴定及分子量测定:样品进行SDS_不连续缓冲系统聚丙烯酰胺凝胶电泳(SDS_PAGE)[7]。
1 2 6 菌体浓度和干重:菌体浓度使用分光光度计测600nm的光吸收值OD600,样品稀释至OD值在0 1~0 7之间。取不同OD值的发酵菌悬液经5000r min离心30min,用PBS清洗2次,离心,称菌体湿重。将湿菌体在90℃烘干至恒定值,用微量分析天平称细胞干重,吸光度与细胞干重在一定范围内呈线性。1 2 7 重组蛋白表达量的测定和蛋白质浓度测定:用常规SDS_PAGE凝胶电泳检测[7],由FR_980凝胶电泳分析仪测定rhIL_2占菌体总蛋白的百分含量。菌体总蛋白浓度测定采用Bradford法[8],以BSA为标准品。
1 2 8 活性测定:IL_2生物活性测定,是检测IL_2激活的IL_2依赖性细胞CTLL的增殖程度,用MTT检测法来测定[9,10]。2 结果与讨论2 1 工程菌表达条件优化2 1 1 诱导时间的影响:考察诱导时间可以了解外源蛋白分泌表达和菌体生长的情况,并可据此判断发酵结束的时间。以含0 5%甲醇的BMMY培养基进行诱导,每12小时取样,平行实验3次,检测结果见图1。从12h开始,随时间延长表达量逐渐增加,培养48h达到高峰值,占总蛋白38%,然后缓慢下降,而菌体浓度变化不大。2 1 2 甲醇诱导浓度的影响:按摇瓶培养法每隔24h分别补加甲醇使其终浓度为0 5%、1%、1 5%、2%、3%、4%、5%,诱导培养48h。平行实验3次以上,结果如下:当甲醇诱导浓度为0 5%时,其残留浓度较低,同时细胞光密度也较低,说明此时甲醇成为限制性底物;当甲醇浓度为1%时,其残留浓度较低但OD600最大,说明在其他条件不变的情况下此浓度最适于菌体生长;当甲醇浓度大于1 5%后,其残留浓度较高,OD600下降,说明在此浓度范围细胞生长受到抑制。从毕赤酵母表达目的蛋白量来看,在甲醇浓度为1%时达到最高。
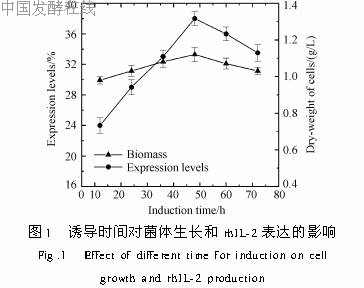
本研究表明,白细胞介素_2的毕赤酵母摇瓶发酵的最佳条件如下:以BMGY作为种子培养基,菌体密度OD600达到9时,重悬于1/5体积的BMMY中开始诱导表达,此时菌体密度相当于OD600达到45,甲醇诱导剂量为1%,pH值6 0,诱导2d,产量达高峰期,最大表达量为0 204g/L。
2 2 rhIL_2纯化rhIL_2粗提液经强阳离子交换S柱色谱,得到四个峰(图2),电泳鉴定其中0 55mol LNaCl洗脱组分为rhIL_2,位于第4峰,纯度达85%。离子交换分离得到的较纯的rhIL_2经SephedexG_100凝胶过滤色谱分离,得到3个组分(图3),电泳鉴定rhIL_2位于第2、3峰间,靠近3峰,合并样品46~48管,电泳鉴定为单一条带(上样量20μg),纯度为98%。纯化样品的电泳结果如图4。纯化过程总的回收率27%,见Table1。将最后纯化得到的rhIL_2上高压液相色谱(HPLC),只有一条带(图5)。
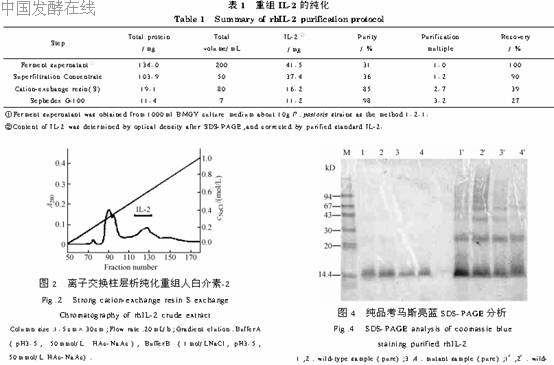

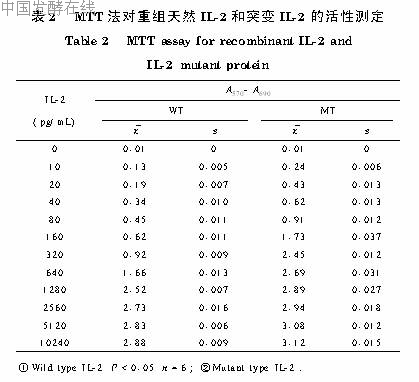
2 3 分子量的测定6种标准蛋白分子量分别为94kD、67kD、43kD、30kD、20kD、14 4kD(图4),将其迁移率对分子量的对数作图,所得标准曲线为lgMr=4 962_1 168Rf,相关系数r=-0 986(P<0 001,n=5)。将rhIL_2迁移率代入计算得分子量为14 5kD,与理论值15kD相差小于5%,基本符合。2 4 生物活性测定上述纯化所得的rhIL_2纯品用MTT法测活,每微克IL_2加入50μg牛血清白蛋白(BSA)定容于50mmol L乙酸铵pH4 0中,冷冻干燥成干粉。用MTT法测活前,溶解于4mmol LHCl中并达到含0 1%BSA,制成IL_2终浓度为1μg mL的缓冲液,并用0 2μm微孔滤膜过滤。表2显示该样本两次测活的结果。每一次测活代表同一样本重复3次。结果显示样本两次测定虽有差异,但突变型IL_2引起CTLL_2细胞的增殖明显高于野生型IL_2,并可从中计算出突变型IL_2的活力是野生型IL_2的4 4倍。
利用大肠杆菌、酵母和哺乳动物细胞已成功表达了重组人IL_2,不过大量生产重组IL_2主要还是使用大肠杆菌,因此有关rhIL_2的纯化也多限于从大肠杆菌中提取。从大肠杆菌中生产重组IL_2的方法已成熟[3,11]。虞建良[12](1995年)构建了IL_2的高效表达质粒,获得了高产工程菌株,并建立了目前国内外最为简单迅速而高效的IL_2纯化方法。本文首次在巴斯德毕赤酵母中表达与纯化分泌型天然及突变型rhIL_2,从该表达系统中纯化rhIL_2是一个全新的探索过程,用大肠杆菌生产rhIL_2首先遇到的就是包含体的处理问题。无论采用促溶剂盐酸胍或尿素还是表面活性剂十二烷基硫酸钠(SDS)两种方法,促使rIL_2从包含体中溶出,但都存在一定的缺点,如SDS可与IL_2结合,盐酸胍和尿素会使大量杂蛋白与IL_2一起进入沉淀,造成进一步纯化困难。用巴斯德毕赤酵母表达的rhIL_2是分泌型的,即rhIL_2在诱导表达过程中直接分泌到发酵液中,突破了大肠杆菌对包含体的处理问题及rhIL_2的变性、复性问题。
将发酵液离心除去菌体,经SDS_PAGE检测上清,rhIL_2占所有被分泌蛋白的30%以上,背景蛋白相对较少。离心获得的含有rhIL_2的上清液进一步纯化脱盐,考虑到分泌型表达产物的发酵液的体积很大,但浓度较低,因此第一步处理选用超滤浓缩,使浓缩、脱盐且更换缓冲液一步完成,并且在一定程度上去除杂蛋白,这样得到的含rhIL_2浓缩液可以直接上离子交换柱。离子交换柱选用强阳离子交换柱,pH3 5,在这个pH下IL_2是可溶的,并且经NaCl梯度洗脱可达到39%的回收率。而且大多数毕赤酵母蛋白不会吸附到这种树脂上,可以获得很好的纯化效果,洗脱后可以得到85%纯度的IL_2。凝胶过滤色谱放在最后一步不仅起到进一步纯化的结果,而且可以直接过渡到适当的缓冲体系中,以利于产品成型保存。纯化过程简单迅速,费用低廉,只是得率有待进一步提高。为了在相同条件下比较白细胞介素_2突变型蛋白与野生型蛋白的特性,我们同时对两种蛋白进行了表达与纯化。虽然突变型蛋白在三个氨基酸位点上发生了改变,但在毕赤酵母中由于属于分泌表达,不存在变性、复性、二硫键错配的问题,并且产生的突变蛋白只是引起胞内小体中pH值的微小变化,对纯化没有影响。两种蛋白的表达纯化过程完全相同。纯化得到的变异IL_2,其活性比野生型IL_2高4~5倍,这与作者的初衷相符,即期望得到一高活性,低毒性的新型IL_2。正是由于其高活性,因而对其作进一步的毒理实验,动物实验等便显得很有意义,将其开发成一类新药便有了一定的基础。
相关热词搜索:白细胞介素_2
上一篇:卫星搭载选育金霉素高产菌的研究
下一篇:侧胞芽孢杆菌发酵工艺的研究
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

