亲水醇/盐 水双液相体系萃取赤霉素的研究
2007-05-10 21:51:02 来源:分析化学(FENXIHUAXUE) 研究简报 评论:0 点击:
1 引 言
赤霉素(gibberellins,GA3)是二萜羧酸结构的高效酸性植物激素,有促进细胞生长,增加作物产量等功效。采用加热浓缩的方法提取纯化,能耗大,产品质量差。用溶剂萃取[1]、树脂吸附[2]、色谱法、膜分离的研究也较多,但是存在三废,污染大、成本高、操作周期长、处理量有限等缺点。色谱法适于分离测定,不适于制备;膜分离也由于价格昂贵,制备容量低阻碍了它的发展。本法采用醇/盐 水双液体系萃取赤霉素,操作简单,成本低,条件温和,无三废,收率高,纯度好,克服了上述方法的缺陷,而且后续处理只需低温馏去可回收的小分子醇,即得固体产品。所以本方法是一种简便廉价、安全有效的提取方法。醇/盐 水双液体系虽然已用于血清中铬[3]、生物物质[4]、中草药有效成分[5]的提取。但是,尚未见用于赤霉素萃取的文献报道。该法不仅能提取植物激素类物质,还可从发酵液中直接萃取植物激素,有很大的实际应用意义。
2 实验部分
2.1 仪器与试剂Lambdar35紫外 可见分光光度计(美国PE公司);NEXUS470傅里叶红外光谱仪(美国NICOLET公司);气相色谱仪(含GC 17AATF气相色谱仪、FID检测器、中等极性石英毛细管色谱柱25m×0.32mm,日本岛津公司);高效液相色谱仪(含210分析/半制备HPLC,USA,配备210型传输泵、500型柱阀箱、325型紫外可见检测器,美国Prostar公司)。赤霉素(gibberellin,GA3,>97%,Sanland chemInternationalInc);HAc NaAc缓冲溶液按常规方法配制;D101离子交换树脂。异丙醇、硫酸铵均为市售分析纯试剂。
2.2 实验方法向25mL比色管(经容量校正)中加入一定量赤霉素试液、异丙醇、缓冲溶液,定容至10.0mL,加入一定量硫酸铵,振荡3~5min,静置5min,测量上下相的体积比。分出上相,测定其中赤霉素含量。正交实验确定最佳分离条件。分光光度法测定异丙醇相中赤霉素含量[6]。上相提取液稀释20倍,HCl调节pH为2.0,上柱,柱长为17cm的D101树脂交换。交换完毕,50mL二次水冲洗柱子。甲醇作洗脱液,收集25mL洗脱液。详见文献[7]。液相色谱条件:流动相甲醇,流速0.8mL/min;检测波长254nm;温度35℃。气相色谱条件[8]:柱箱温度230℃,汽化室温度280℃,检测器温度280℃,载气N2,柱压150kPa。用提取物与原样对照,考察对豆类作物(绿豆)生长的影响[9],实验提取物的生理活性。

3 结果与讨论
3.1 醇/盐 水双液相体系实验因素正交设计体系组成与被萃物的存在形式决定提取效果,两者均受体系pH的影响。萃取结果也受被萃物含量的影响,故以醇盐比、酸度、萃取物浓度3因素作正交实验,优化提取条件。本研究选用异丙醇 硫酸铵 H2O体系。设计了L16(43)实验,各因素对结果的影响如下:体系组成(醇盐比)>酸度>赤霉素浓度;按该顺序研究三种因素对体系的影响,选取最佳分离条件。
3.2 体系分离条件的优选
3.2.1 体系组成(醇盐比)的确定 成相盐和醇浓度改变,体系的相行为发生相应变化。在实验的萃取条件下,赤霉素以分子形式存在,分散到醇相,达到发酵液中的赤霉素与其它物质分离的效果。醇盐比较大的点,下相残余较大量的醇,被萃物在下相的残留增多,提取率降低。选取高盐低醇成相,即图1 ;中异丙醇∶硫酸铵(1.5mL∶4.3g),其相比小,富集倍数大,可获得较好的提取结果。醇盐比对相比影响很大,随醇盐比的增加,富集倍数呈明显的下降趋势。
3.2.2 酸度对提取的影响 酸度是影响双液相体系萃取的重要因素之一,它不仅对相系的成相造成影响,而且会影响被萃物的存在状态,导致萃取结果的差异。无机盐是体系的成相组分,使体系中有较高的离子强度,少量酸碱对体系成相影响不明显,缓冲溶液不会使体系成相发生变化。因此,萃取结果的差异主要是由酸度对赤霉素存在状态的改变所致。赤霉素溶液呈酸性,低pH条件有利于萃取分离。在较强酸度下,赤霉素以稳定分子形式存在,提取率主要取决于其在醇中的溶解性能。pH增高,赤霉素存在状态发生改变,导致溶解性能变化。pH6.0时,赤霉素在水中也有较好的溶解性,水相也会残留大量的赤霉素。图2表明,高pH下赤霉素的提取率下降;赤霉素在pH值3.0~4.0的溶液中最稳定。pH过高或过低都会使赤霉素变成无生理活性的伪赤霉素或赤霉烯酸。图2显示,最佳提取酸度在pH4.0。
3.2.3 体系的萃取容量 在上述选定的醇盐比及萃取酸度下,研究体系中赤霉素的萃取容量。结果表明,赤霉素浓度<0.064g/L时可完全萃取且结果稳定,重现性好。浓度较低时,分子分散,不易于上相的富集。
3.2.4 外加物对相系萃取的影响 赤霉素发酵液常含NaCl和葡萄糖。实验发现,加入适量NaCl,对醇相提取有利。葡萄糖为六元醇,参与醇羟基与无机盐争夺水分子,并且,无论是与赤霉素羧基发生酯化携带赤霉素,还是从质子化角度考虑,都不利于醇相对赤霉素的提取。葡萄糖量<0.4g/10mL,对萃取结果负效应小,而且发酵液中的无机盐量(10g/L)也利于体系萃取的范围。无机盐的正面作用抵消了少量葡萄糖的负效应,不会对萃取结果造成影响。
3.2.5 加入回收实验 参照文献[10],制备赤霉素模拟发酵液。在优选的条件下加入0.06g/L的GAs作回收实验。回收率为93.5%,RSD为4.0%。加入回收结果证明了实验的重现性。
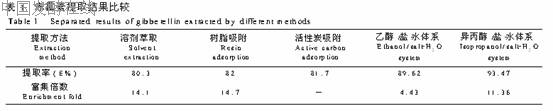
3.2.6 与其它方法提取结果的比较 几种方法提取结果的比较表明(见表1),异丙醇/盐 水体系除了前面所述的优点,提取效果也有明显优势。
3.3 提取物的确证
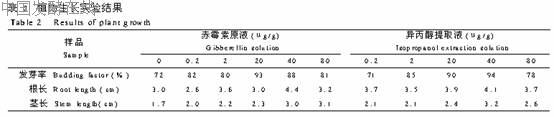
3.3.1 结构定性印证 紫外扫描结果显示,提取物与原赤霉素最大吸收峰均在250nm处,峰位置没发生变化。证实提取物的共轭结构不受萃取体系的影响。提取液于40℃鼓风干燥4h后35℃隔夜真空干燥。标准物质及提取物的红外光谱扫描结果显示:因醇、盐等物质的存在,使谱图中少数峰稍有偏移,或峰形的轻微扩张,但提取物的红外光谱图显示的特征峰位置与标准品基本一致。UV和IR的结果表征说明,萃取体系不影响提取物的结构。3.3.2 提取物纯度色谱定性 因赤霉素摩尔质量较小,故用离子交换法脱盐处理,进行色谱定性。图3的液相色谱图显示,除了4.29min出现甲醇的溶剂峰外,赤霉素的保留时间均为3.53min。为确认提取物是在萃取体系被纯化,作GC实验,并借乙醇作成相剂的萃取结果对照说明。图4为 赤霉素原样、乙醇提取样、异丙醇提取样的甲醇溶液的气相色谱峰形。结果显示,在保留时间约4.7min均出现形状相似峰形。色谱定性前均经过相同的离子交换预处理残留于醇相的盐,比较图4中体系4与3,体系4的杂质峰大大减少,表明异丙醇相对赤霉素的提取有纯化作用。也可作为合理的实验结果证实,赤霉素的纯化是醇/盐水体系萃取实现,而不是离子交换。多次扫描的色谱图谱的再现性也很好。表明异丙醇/盐 水萃取体系,对发酵液中赤霉素的提取有较高的选择性。3.3.3 生物活性实验结果 表2可以看出,同浓度对照组相比,对绿豆的发芽率及幼苗的生长的影响结果基本一致。说明醇/盐 水体系萃取的赤霉素对作物的生长同样发挥作用。
相关热词搜索:赤霉素
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

