固定化玫瑰微球菌发酵产海藻糖合成酶系
2007-04-03 11:37:24 来源:北京化工大学学报 评论:0 点击:
D 海藻糖作为一种天然保鲜剂,可有效抑制淀粉老化、蛋白质变性、脂质氧化和微生物污染等引起食品变质[1],而且无毒无害,已被美国食品药品监督管理局和欧洲立法系统批准为一种安全的食品添加剂[2],此外,用作生物制剂的保存剂和化妆品的保湿成分等亦有良好效果[3 4]。自从能够以淀粉为原料,通过酶转化生产海藻糖以来,其价格大幅度下降,使其在各个应用领域的广泛应用成为可能。本文采用微球菌发酵产胞内酶系麦芽糖苷基海藻糖合成酶MTSase和麦芽糖苷基海藻糖水解酶MTHase,全细胞酶反应催化淀粉转化为海藻糖,其中发酵产酶是整个过程中关键性步骤,因此有必要对其进行更进一步的研究。利用细胞固定化技术提高细胞生长速率、活性及稳定性,实现连续培养,在国内外已有报道。对发酵产胞内酶而言,固定化发酵过程可以是一部分菌体吸附在多孔载体上,另一部分菌体随发酵液被移出,用于进行下一步酶反应。在移出发酵液的同时,不断流加新鲜培养基,从而实现连续培养,提高酶的时空产率,此方面研究在国内外鲜有报道。本文以聚氨酯为载体,考察了固定化细胞对菌体生长和产酶活力的影响,以及固定化细胞重复批次发酵效果,在摇瓶中初步探索了重复批次发酵较适宜的换液量和换液时间的基础上,在10L发酵罐中进行了放大试验。结果显示固定化不仅大大缩短了发酵周期,提高了酶的时空产率,而且简化了发酵过程,省去不断进行种子培养和接种的繁杂工作,降低了能耗。
1 材料与方法
1 1 材料
1 1 1 菌种 玫瑰微球菌为本实验室自筛选诱变而得。
1 1 2 培养基(g/L) 固体培养基:可溶性淀粉20,蛋白胨10,牛肉膏5,NaCl5,pH7 0。种子培养基:葡萄糖30,牛肉蛋白胨10,酵母浸粉5,牛肉粉3,K2HPO4·3H2O1,NaH2PO41,MgSO4·7H2O0 5,CH3COONa0 1,pH(8 0±0 5),过膜添加VB120 005%。摇瓶发酵培养基:葡萄糖20,蛋白胨5,酵母浸粉1,K2HPO4·3H2O2,MgSO4·7H2O0 5,pH(8 0±0 5)。发酵罐培养基:葡萄糖20,玉米浆50,黄豆饼粉5,K2HPO4·3H2O2,MgSO4·7H2O0 5,pH(8 0±0 5)。
1 1 3 载体 由北京恒跃海绵制品厂购得5种聚氨酯,记为A、B、C、D和E型。
1 2 实验方法
1 2 1游离细胞培养 摇瓶培养:将菌种由斜面接种到种子培养基中,装液量50mL/250mL,30℃,140r/min,培养20h;后以10%的接种量转接于摇瓶发酵培养基中,30℃,180r/min,培养96h。发酵罐培养:将菌种由斜面接种到种子培养基中,装液量50mL/250mL,30℃,140r/min,培养20h;以10%的接种量转接到摇瓶发酵培养基中,30℃,180r/min,培养18h;最终以10%接种量转接到10L发酵罐中,装液量5L,30℃,200~250r/min,通气量9L/min,培养48h。
1 2 2 固定化细胞培养 载体预处理:将聚氨酯处理成5mm×5mm×5mm的小块,用蒸馏水洗净并浸泡24h,121℃灭菌20min,烘干待用。固定化:将一定量经预处理的载体小块加入摇瓶或发酵罐培养基中共同灭菌后接种,进行固定化细胞培养,发酵条件与游离细胞培养相同。重复批次发酵换液:固定化细胞培养至酶活达到最大值,无菌条件下移出一定量发酵液,测定其生物量和酶活等参数,再将等量新鲜培养基加入反应器内,与剩余发酵液及固定化细胞共同继续培养,一定时间间隔后,再重复上述操作。
1 2 3 发酵参数测定 细胞质量浓度测定:细胞质量浓度(g/L)采用细胞干重法。菌体于60℃烘干至恒重,精确称重。残糖浓度测定:残糖浓度测定采用DNS[5]法,标准曲线方程为y=3 526x+0 0056,线性相关系数R=0 9974,其中x为550nm波长下的吸光度,y为还原糖浓度(mg/mL)。酶活测定:发酵液3000r/min离心10min,收集菌体,生理盐水洗涤2次,离心备用。将1g湿菌体悬浮于5mL0 1M,pH=8的磷酸缓冲液中,经甲苯透性化处理[6]后,加入相同体积的浓度为15%的淀粉液化液,30℃振荡反应4h。11000r/min离心2min,取上清,测定海藻糖含量。海藻糖含量测定采用HPLC法[7 8]。高效液相色谱为日立LA 10vp型,采用ZORBAX NH2柱(150cm),柱温30℃,流动相为乙腈-水,体积比为78∶22,流速1mL/min;示差折光检测器。以上各参数每个数值点测定3次,取平均值±标准偏差为最终测定结果。酶活定义为每分钟转化淀粉得到1μg海藻糖所需的酶量为1个酶活力单位(u)[9]。酶的时空产率定义为每升发酵液发酵1h产酶的酶活,单位为u/(L·h)。
2 结果与讨论
2 1 载体选择以相同的添加量8g/L,将A、B、C、D和E5种聚氨酯经预处理后添加到培养基中,固定化细胞培养96h,测定酶活。由图1可见,以B型聚氨酯为载体的固定化细胞发酵产酶的酶活最高。因此选择B型聚氨酯为固定化载体。
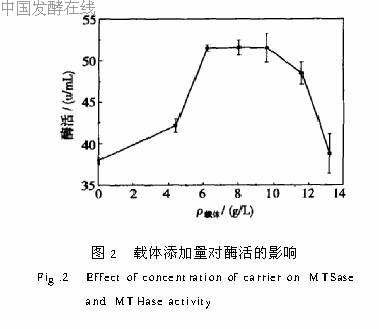
2 2 载体添加量选择图2为B型聚氨酯载体添加量对固定化细胞培养产酶的影响。如图所示酶活随载体添加量的变化在不同范围内呈现不同趋势,添加量小于6g/L时,酶活随载体添加量的增大而升高,在6~10g/L范围内酶活保持稳定,大于10g/L时,酶活随载体添加量的增大而下降。从成本角度考虑,选择6g/L为载体添加量。
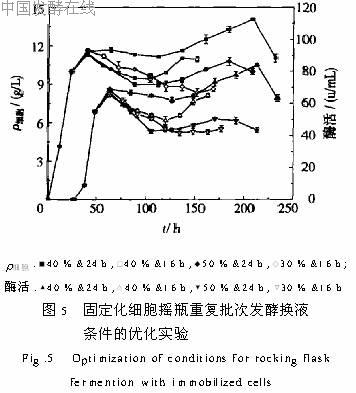
对比24h&40%和24h&50%两组条件,24h&40%优于24h&50%。这可能是由于24h&50%条件下,换液量过大,部分吸附在载体内菌体随发酵液被移出,导致下一批发酵的种子量较少,因此菌体生长及产酶效果不如24h&40%。综上所述,摇瓶固定化细胞培养较适宜的换液条件为发酵40h后,以40%的替换量每隔24h以新鲜培养基替换发酵液,在此条件下,重复换液9批,230h细胞质量浓度及酶活无明显下降。
2 6 发酵罐换液试验参考摇瓶最优载体添加量和换液条件,在10L发酵罐内进行固定化细胞重复批次发酵的放大实验,各批次菌体生长及产酶情况如图6所示。发酵罐内培养,细胞质量浓度及酶活最高分别达到17g/L和80u/mL,比摇瓶培养提高了40%和60%,重复换液7批,连续180h细胞质量浓度维持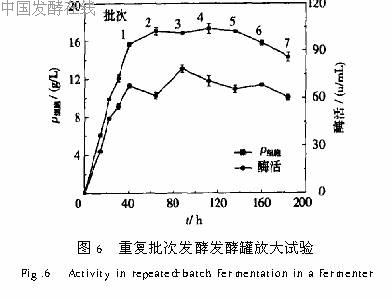
在15g/L以上,酶活维持在60u/mL以上,酶的时空产率达到56 9u/(L·h),比游离细胞培养单批发酵提高42 5%。
3 结论
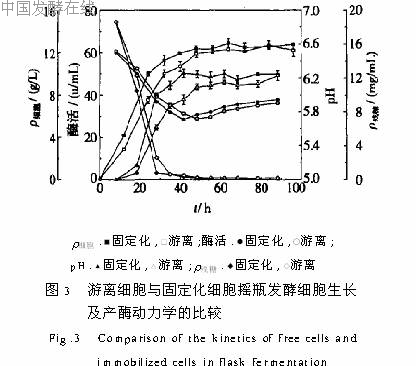
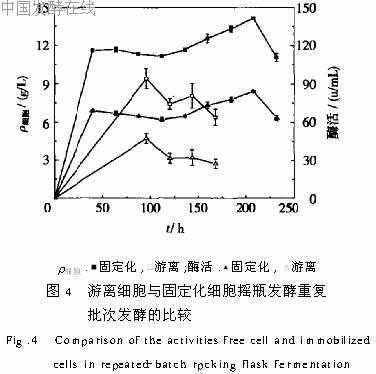
(1)通过载体类型和载体添加量的选择,以及游离细胞与固定化细胞培养的对比发现,在一定的载体添加量范围内,固定化对菌体生长及产酶起到促进作用。(2)将固定化细胞与游离细胞培养进行重复批次换液的对比后得出结论,游离细胞稳定性差,重复批次发酵是不可行的,只有固定化才能实现重复批次发酵。(3)参考摇瓶重复批次发酵最适宜的换液条件在10L发酵罐中进行的放大实验,生物量明显高于相同条件下的摇瓶发酵,最高酶活与之相比提高60%,但平均酶活与之相当,而且只能重复换液7批,连续发酵180h,不如摇瓶发酵持续时间长。因此换液条件、替换培养基的成分、pH值和搅拌转速等参数还有待优化,固定化细胞重复批次发酵产酶有望达到更佳的效果。
相关热词搜索:基因工程菌
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

