利用原生质体诱变筛选植酸酶高产菌株
2010-10-14 22:14:18 来源:本站原创 评论:0 点击:
李秀珍 薄 泉 杨平平 王 燕
摘 要 对产植酸酶的纯化黑曲霉用混合酶制取原生质体进行了研究。研究发现,经诱变后的原生质体在再生过程中菌落形态发生了明显变化,从中选育出了一株植酸酶的高产菌株,并对其遗传稳定性进行了鉴定。
关键词 植酸酶;黑曲霉;紫外诱变;原生质体
中图分类号 Q814
1 材料与方法
1.1 材料
1.1.1 主要原料及试剂
植酸钠(由美国Sigma公司提供)、钼酸铵、冰醋酸、磷酸二氢钾、三水乙酸钠、偏钒酸铵、葡萄糖、氯化钾、硫酸镁、硫酸锰、硝酸等。
1.1.2 菌种
实验室保藏的黑曲霉2株、米曲霉1株。
1.1.3 培养基
斜面培养基:PDA培养基,自然pH值。
初始平板分离培养基:麦芽汁培养基(糖度为5.8),121 ℃灭菌20 min,自然pH值。
产酶培养基:100 ml培养基中含葡萄糖 3.0 g、NH4NO3 0.5 g、KCl 0.05 g、MgSO4·7H2O 0.05 g、MnSO4·7H2O 0.03 g、FeSO4·7H2O 0.03 g、植酸钙 0.01 g,121 ℃灭菌20 min,自然pH值。
再生平板培养基:100 ml培养基中含葡萄糖 4.0 g、NaNO3 0.3 g、KCl 0.05 g、MgSO4·7H2O 0.05 g、FeSO4·7H2O 0.001 g、KH2PO4 0.01 g,用0.6 mol/l NaCl溶液配制,自然pH值,121 ℃灭菌20 min。
1.2 方法
1.2.1 菌种筛选
1.2.1.1 菌种初筛
将实验室保存的菌种运用稀释平板法分离,30 ℃培养3 d,选取单菌落(50株)接入斜面培养基,每种菌株斜面接入到1个三角瓶进行发酵,250 ml三角瓶装液量为50 ml,30 ℃、200 r/min摇瓶培养72 h,测定酶活。
1.2.1.2 菌种复筛
经初筛得到3~5株酶活较高的菌株,每种菌株斜面接入3个三角瓶进行平行发酵试验,250 ml三角瓶装液量为50 ml,30 ℃、200 r/min摇瓶培养72 h,测定酶活。
1.2.2 原生质体的制备
1.2.2.1 黑曲霉菌丝液的制备
将生长5 d的黑曲霉斜面孢子洗下,在6度麦芽汁中摇瓶培养8~12 h,收集菌丝体;菌丝用无菌水离心洗涤(5 000 r/min)2次,并用高渗液(0.6 mol/l NaCl)稀释适当倍数。
1.2.2.2 原生质体的制备
取菌丝悬浮液1 ml,加入1%的纤维素酶、1%的蜗牛酶溶液各0.5 ml,37 ℃水浴,振荡处理3~4 h,取样镜检,当有大量原生质体形成时停止酶处理,再用高渗液(0.6 mol/l NaCl)洗涤原生质体,500 r/min离心,即得原生质体。
1.2.3 原生质体紫外诱变及再生
原生质体用高渗液稀释至适当倍数,取10 ml放入无菌的Φ为9 cm平板内,30 W紫外灯,距平板30 cm处照射5、10、15 min后,红光下涂布于再生平板上,观察菌落生长情况。
1.2.4 植酸酶酶活的测定
以植酸钠为底物,采用钒钼酸铵法测定植酸酶的酶活。
将培养72 h的发酵液经4 000 r/min离心除去菌体,利用截流分子量为10 000 Da的透析袋在无离子水中将上清液透析2 h,得到去除无机磷的酶液。吸取1 mmol/l的植酸钠(酶作用底物,用0.25 mol/l、pH值5.50醋酸-醋酸钠缓冲液配制)1.0 ml,37 ℃预热5 min后,准确加入适当稀释的酶液0.5 ml(对照组先加反应终止液),37 ℃水浴反应30 min后,再加入4 ml反应终止液(现用现配) 冷却至室温,利用722型可见光分光光度计在415 nm处测定OD值,利用无机磷标准曲线计算出酶活。
酶活单位定义:在37 ℃,每分钟从1 mmol/l植酸钠溶液中(用pH值5.5的醋酸-醋酸钠缓冲液配制)释放出1 nmol无机磷所需要的酶量为一个酶活单位(U)。
1.2.5 诱变菌株的遗传稳定性考察
对选出的有利诱变菌落进行传代接种摇床培养,测其酶活,初步考察其遗传稳定性。
2 结果与分析
2.1 出发菌株的选择
从实验室保存的2株黑曲霉、1株米曲霉中分别分离到50株单菌落,经过反复筛选得到3株酶活较高的菌株,其酶活情况见表1。
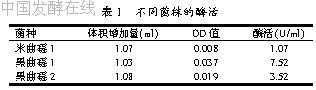
通过多次筛选和酶活大小的比较,黑曲霉1产酶量始终较高,所以选出黑曲霉1为原生质体诱变的出发菌株。
2.2 原生质体的制备
2.2.1 原生质体形态观察(见图1)
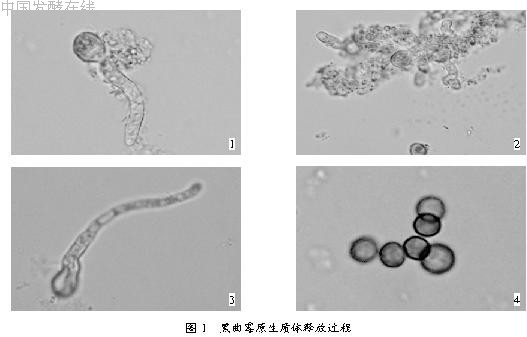
从图1中可以看出,供试菌株的原生质体和其它许多常见丝状真菌一样,可以从菌丝顶端和其它部位释放。在菌丝顶端和其它部位均同时出现菌丝膨大变形情况。这说明细胞壁已被水解掉,细胞膜凸出将要成为原生质体。原生质体释放时,通常是在菌丝的释放部位先膨大形成1个小球体,然后该球体逐渐增大,最后脱离菌丝,有的还可以在原有的释放部位紧接着又形成一个或几个原生质体。释放的原生质体多呈球形,大小不一。
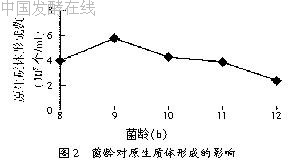
2.2.2 菌龄对原生质体制备的影响
菌体的生理状态对原生质体的形成有很大的影响,用不同菌龄的菌丝制备原生质体的结果见图2。由图2可以看出,随着菌龄的增大,原生质体的产量逐渐减少,以菌龄为9 h时原生质体形成数较高。原因可能是菌龄增大后,菌体细胞老化和细胞壁上沉积较多的不易被酶解的物质,因而不易酶解,或者酶解后得到的原生质体活力不高,不能再生。
2.2.3 不同酶系统对原生质体制备的影响
由于真菌的细胞壁组成比较复杂,由外向内依次是不定形的葡聚糖层、糖蛋白层、蛋白质层、几丁质层。用不同的酶系统制备原生质体的结果见表2。

由表2可以看出,V纤维素酶:V蜗牛酶=3:7时,原生质体产量达到最高,为3.5×105个/ml。
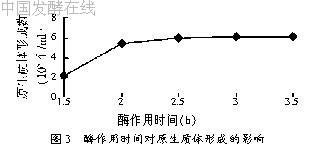
2.2.4 酶作用时间对原生质体制备的影响
酶作用时间不同对制备原生质体的影响见图3。由图3可以看出,2.5 h时原生质体形成数较高,2.5 h以后变化不大。但考虑到酶作用时间越长,细胞脱壁越完全,而原生质体的再生需要一定的细胞壁的酶解残余物作为引物。综合考虑,酶作用时间应该选取2.5 h。
2.3 菌种的诱变选育
2.3.1 诱变的时间(见表3)
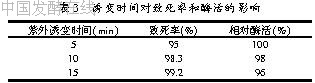
表3结果可见,黑曲霉原生质体经过不同时间的诱变对致死率没有较大的影响,相对酶活也相差不大,因此,诱变时间确定为5 min。
2.3.2 诱变前后菌落形态特征
从菌体诱变前后来看,菌体的生长周期、菌落形态发生了一些变化,表现在:①诱变前后,菌落的生长周期发生了明显变化,原始菌种平板菌落生长期只需2~3 d长成,而诱变后的菌落生长期延迟到了4~5 d。②诱变后的黑曲霉平板菌落比原始菌平板菌落大且厚实。这说明,菌体制成原生质体后,加上紫外线对它的诱变作用,菌体基因确实受到影响,内在基因的变化导致菌体表观的改变,诱变效果比较明显。
2.3.3 高产菌株的选育
经过一轮诱变从中挑选出30株生长旺盛的菌落,接入摇瓶培养基,(30±1) ℃恒温培养72 h后测定酶活,进行初筛。从中挑选出3株酶活较高的菌株进行复筛,结果见表4。
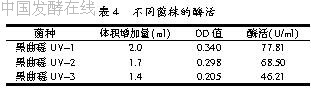
通过多次筛选和酶活大小的比较,黑曲霉UV-1产酶量始终较高。
2.4 遗传稳定性试验
将经原生质体诱变筛选出的高产菌株黑曲霉UV-1连续传代5次,测其酶活,见表5。从表5中可以看出,黑曲霉UV-1的遗传性状基本稳定。

3 结论
本试验以实验室保存的2株黑曲霉和1株米曲霉为出发菌株,经过分离纯化筛选出1株酶活较高的黑曲霉1,采用原生质体紫外诱变处理能显著提高黑曲霉的植酸酶产量,酶活比出发菌株提高了10.35倍,其遗传性状基本稳定。
参考文献
1 Zyla K. Phytase application in poultry feeding:selected issues[J]. Journal of animal and feed science, 2001,10(2):247~258
2 李佳,刘钟滨. 植酸酶的研究进展及应用[J]. 同济大学学报,2004, 25(6):541~545
3 杨平平,许正宏,王燕,等. 植酸酶菌株筛选方法的研究[J]. 工业微生物,2004,34(3):12~15
4 陈红歌,苗雪霞,张世敏.植酸酶高产菌株的诱变选育[J]. 微生物学通报,1997,24(3):27~274
5 彭益强,贺淹才,全成恒. 用原生质体诱变选育高植酸酶酶活的黑曲霉变异株[J]. 微生物学,2002,22(5):7~9
6 杨文博.微生物学实验[M]. 化学工业出版社, 2004. 104~104
7 朱萍,梁海秋,张弘,等. 黑曲霉Ni-5K原生质体的制备及再生[J]. 广西农业生物科学, 2005,24(4):339~342
8 曹军卫. 黑曲霉原生质体的制备及再生[J]. 武汉大学学报(自然科学版), 1984(4):95~102
(编辑:高 雁,snowyan78@tom.com)
李秀珍,山东轻工业学院,250353,山东省济南市西部新城大学科技城。
薄泉,单位及通讯地址同第一作者。
杨平平、王燕(通讯作者),浙江工业大学。
收稿日期:2007-02-20
摘 要 对产植酸酶的纯化黑曲霉用混合酶制取原生质体进行了研究。研究发现,经诱变后的原生质体在再生过程中菌落形态发生了明显变化,从中选育出了一株植酸酶的高产菌株,并对其遗传稳定性进行了鉴定。
关键词 植酸酶;黑曲霉;紫外诱变;原生质体
中图分类号 Q814
1 材料与方法
1.1 材料
1.1.1 主要原料及试剂
植酸钠(由美国Sigma公司提供)、钼酸铵、冰醋酸、磷酸二氢钾、三水乙酸钠、偏钒酸铵、葡萄糖、氯化钾、硫酸镁、硫酸锰、硝酸等。
1.1.2 菌种
实验室保藏的黑曲霉2株、米曲霉1株。
1.1.3 培养基
斜面培养基:PDA培养基,自然pH值。
初始平板分离培养基:麦芽汁培养基(糖度为5.8),121 ℃灭菌20 min,自然pH值。
产酶培养基:100 ml培养基中含葡萄糖 3.0 g、NH4NO3 0.5 g、KCl 0.05 g、MgSO4·7H2O 0.05 g、MnSO4·7H2O 0.03 g、FeSO4·7H2O 0.03 g、植酸钙 0.01 g,121 ℃灭菌20 min,自然pH值。
再生平板培养基:100 ml培养基中含葡萄糖 4.0 g、NaNO3 0.3 g、KCl 0.05 g、MgSO4·7H2O 0.05 g、FeSO4·7H2O 0.001 g、KH2PO4 0.01 g,用0.6 mol/l NaCl溶液配制,自然pH值,121 ℃灭菌20 min。
1.2 方法
1.2.1 菌种筛选
1.2.1.1 菌种初筛
将实验室保存的菌种运用稀释平板法分离,30 ℃培养3 d,选取单菌落(50株)接入斜面培养基,每种菌株斜面接入到1个三角瓶进行发酵,250 ml三角瓶装液量为50 ml,30 ℃、200 r/min摇瓶培养72 h,测定酶活。
1.2.1.2 菌种复筛
经初筛得到3~5株酶活较高的菌株,每种菌株斜面接入3个三角瓶进行平行发酵试验,250 ml三角瓶装液量为50 ml,30 ℃、200 r/min摇瓶培养72 h,测定酶活。
1.2.2 原生质体的制备
1.2.2.1 黑曲霉菌丝液的制备
将生长5 d的黑曲霉斜面孢子洗下,在6度麦芽汁中摇瓶培养8~12 h,收集菌丝体;菌丝用无菌水离心洗涤(5 000 r/min)2次,并用高渗液(0.6 mol/l NaCl)稀释适当倍数。
1.2.2.2 原生质体的制备
取菌丝悬浮液1 ml,加入1%的纤维素酶、1%的蜗牛酶溶液各0.5 ml,37 ℃水浴,振荡处理3~4 h,取样镜检,当有大量原生质体形成时停止酶处理,再用高渗液(0.6 mol/l NaCl)洗涤原生质体,500 r/min离心,即得原生质体。
1.2.3 原生质体紫外诱变及再生
原生质体用高渗液稀释至适当倍数,取10 ml放入无菌的Φ为9 cm平板内,30 W紫外灯,距平板30 cm处照射5、10、15 min后,红光下涂布于再生平板上,观察菌落生长情况。
1.2.4 植酸酶酶活的测定
以植酸钠为底物,采用钒钼酸铵法测定植酸酶的酶活。
将培养72 h的发酵液经4 000 r/min离心除去菌体,利用截流分子量为10 000 Da的透析袋在无离子水中将上清液透析2 h,得到去除无机磷的酶液。吸取1 mmol/l的植酸钠(酶作用底物,用0.25 mol/l、pH值5.50醋酸-醋酸钠缓冲液配制)1.0 ml,37 ℃预热5 min后,准确加入适当稀释的酶液0.5 ml(对照组先加反应终止液),37 ℃水浴反应30 min后,再加入4 ml反应终止液(现用现配) 冷却至室温,利用722型可见光分光光度计在415 nm处测定OD值,利用无机磷标准曲线计算出酶活。
酶活单位定义:在37 ℃,每分钟从1 mmol/l植酸钠溶液中(用pH值5.5的醋酸-醋酸钠缓冲液配制)释放出1 nmol无机磷所需要的酶量为一个酶活单位(U)。
1.2.5 诱变菌株的遗传稳定性考察
对选出的有利诱变菌落进行传代接种摇床培养,测其酶活,初步考察其遗传稳定性。
2 结果与分析
2.1 出发菌株的选择
从实验室保存的2株黑曲霉、1株米曲霉中分别分离到50株单菌落,经过反复筛选得到3株酶活较高的菌株,其酶活情况见表1。

通过多次筛选和酶活大小的比较,黑曲霉1产酶量始终较高,所以选出黑曲霉1为原生质体诱变的出发菌株。
2.2 原生质体的制备
2.2.1 原生质体形态观察(见图1)

从图1中可以看出,供试菌株的原生质体和其它许多常见丝状真菌一样,可以从菌丝顶端和其它部位释放。在菌丝顶端和其它部位均同时出现菌丝膨大变形情况。这说明细胞壁已被水解掉,细胞膜凸出将要成为原生质体。原生质体释放时,通常是在菌丝的释放部位先膨大形成1个小球体,然后该球体逐渐增大,最后脱离菌丝,有的还可以在原有的释放部位紧接着又形成一个或几个原生质体。释放的原生质体多呈球形,大小不一。
2.2.2 菌龄对原生质体制备的影响
菌体的生理状态对原生质体的形成有很大的影响,用不同菌龄的菌丝制备原生质体的结果见图2。由图2可以看出,随着菌龄的增大,原生质体的产量逐渐减少,以菌龄为9 h时原生质体形成数较高。原因可能是菌龄增大后,菌体细胞老化和细胞壁上沉积较多的不易被酶解的物质,因而不易酶解,或者酶解后得到的原生质体活力不高,不能再生。

2.2.3 不同酶系统对原生质体制备的影响
由于真菌的细胞壁组成比较复杂,由外向内依次是不定形的葡聚糖层、糖蛋白层、蛋白质层、几丁质层。用不同的酶系统制备原生质体的结果见表2。

由表2可以看出,V纤维素酶:V蜗牛酶=3:7时,原生质体产量达到最高,为3.5×105个/ml。
2.2.4 酶作用时间对原生质体制备的影响
酶作用时间不同对制备原生质体的影响见图3。由图3可以看出,2.5 h时原生质体形成数较高,2.5 h以后变化不大。但考虑到酶作用时间越长,细胞脱壁越完全,而原生质体的再生需要一定的细胞壁的酶解残余物作为引物。综合考虑,酶作用时间应该选取2.5 h。

2.3 菌种的诱变选育
2.3.1 诱变的时间(见表3)

表3结果可见,黑曲霉原生质体经过不同时间的诱变对致死率没有较大的影响,相对酶活也相差不大,因此,诱变时间确定为5 min。
2.3.2 诱变前后菌落形态特征
从菌体诱变前后来看,菌体的生长周期、菌落形态发生了一些变化,表现在:①诱变前后,菌落的生长周期发生了明显变化,原始菌种平板菌落生长期只需2~3 d长成,而诱变后的菌落生长期延迟到了4~5 d。②诱变后的黑曲霉平板菌落比原始菌平板菌落大且厚实。这说明,菌体制成原生质体后,加上紫外线对它的诱变作用,菌体基因确实受到影响,内在基因的变化导致菌体表观的改变,诱变效果比较明显。
2.3.3 高产菌株的选育
经过一轮诱变从中挑选出30株生长旺盛的菌落,接入摇瓶培养基,(30±1) ℃恒温培养72 h后测定酶活,进行初筛。从中挑选出3株酶活较高的菌株进行复筛,结果见表4。

通过多次筛选和酶活大小的比较,黑曲霉UV-1产酶量始终较高。
2.4 遗传稳定性试验
将经原生质体诱变筛选出的高产菌株黑曲霉UV-1连续传代5次,测其酶活,见表5。从表5中可以看出,黑曲霉UV-1的遗传性状基本稳定。

3 结论
本试验以实验室保存的2株黑曲霉和1株米曲霉为出发菌株,经过分离纯化筛选出1株酶活较高的黑曲霉1,采用原生质体紫外诱变处理能显著提高黑曲霉的植酸酶产量,酶活比出发菌株提高了10.35倍,其遗传性状基本稳定。
参考文献
1 Zyla K. Phytase application in poultry feeding:selected issues[J]. Journal of animal and feed science, 2001,10(2):247~258
2 李佳,刘钟滨. 植酸酶的研究进展及应用[J]. 同济大学学报,2004, 25(6):541~545
3 杨平平,许正宏,王燕,等. 植酸酶菌株筛选方法的研究[J]. 工业微生物,2004,34(3):12~15
4 陈红歌,苗雪霞,张世敏.植酸酶高产菌株的诱变选育[J]. 微生物学通报,1997,24(3):27~274
5 彭益强,贺淹才,全成恒. 用原生质体诱变选育高植酸酶酶活的黑曲霉变异株[J]. 微生物学,2002,22(5):7~9
6 杨文博.微生物学实验[M]. 化学工业出版社, 2004. 104~104
7 朱萍,梁海秋,张弘,等. 黑曲霉Ni-5K原生质体的制备及再生[J]. 广西农业生物科学, 2005,24(4):339~342
8 曹军卫. 黑曲霉原生质体的制备及再生[J]. 武汉大学学报(自然科学版), 1984(4):95~102
(编辑:高 雁,snowyan78@tom.com)
李秀珍,山东轻工业学院,250353,山东省济南市西部新城大学科技城。
薄泉,单位及通讯地址同第一作者。
杨平平、王燕(通讯作者),浙江工业大学。
收稿日期:2007-02-20
分享到:
 收藏
收藏
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

