植物丙酮酸脱氢酶系及其调节酶的研究进展
2007-12-18 23:45:36 来源:食品与发酵工业 评论:0 点击:
摘要:糖类需氧氧化过程的限速步骤是丙酮酸的脱羧氧化,催化此反应的酶是丙酮酸脱氢酶系(pyruvate dehydrogenase complex,PDC)。PDC存在于线粒体中,其核心结构由三种酶组成。丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK),是PDC的负调控酶,负责催化丙酮酸脱氢酶(Pyruvate dehydrogenase,PDH)磷酸化使其失活。丙酮酸脱氢酶磷酸酶(Pyruvate dehydrogenase phosphatase,PDP)则催化已磷酸化的PDH去磷酸化使其复活。本文主要从酶的结构及作用机制方面作简单概述。
关键词:丙酮酸脱氢酶系;丙酮酸脱氢酶激酶;丙酮酸脱氢酶磷酸酶
作者简介:谭才邓(1980-),汉,广东台山人,助教,在职攻读硕士研究生,研究方向:植物基因工程。
1.丙酮酸脱氢酶系(PDC)
1.1丙酮酸脱氢酶系的组成与结构
丙酮酸脱氢酶系的核心结构是由丙酮酸脱氢酶(PDH,简称E1,EC
PDC是一个十分大的多酶体系。原核细胞如大肠杆菌的PDC含有24个E2单位(构成六面体结构核心框架,图1-A),24个E1单位和6个E3单位。真核细胞的PDC更大,以哺乳动物为例,其PDC含有60个E2单位(构成十二面体结构核心框架,图1-B),20~30个E1单位,6个E3单位,还有12个E3结合蛋白。其中E2是PDC结构核心部分,起着结构框架作用,E1和E3结合在E2复合体上起功能作用(图1-C、D)。E1是由两个α亚基和两个β亚基构成的四聚体结构。目前对E2的结构研究得比较祥细,E2单位的分子量是52 kDa,是复合体的核心部分,每个E2多肽链至少包含三个结构域(图2):①N端的疏水结构,负责探连E1与E3,此结构域因物种差异有多个重复,但只有一处起到探连的作用;②中部的结合部位,是与E1、E3紧密结合的部位;③C端的催化活性部位。E3的分子量是55 kDa ,由2个α亚基构成,以FAD为辅因子。
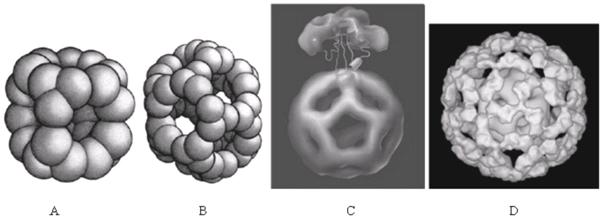
图1 A:原核PDC的E2六面体结构核心框架图; B:真核PDC的E2十二面体结构核心框架图; C:E1三体结合上E2结构核心框架图; D:PDC的E1全部结合上E2结构核心框架图。
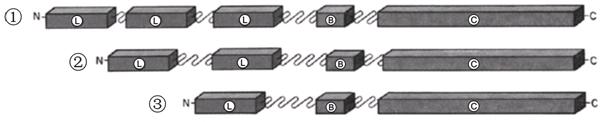
图2 PDC的E2亚单位结构域图。①大肠杆菌的E2单体结构域;②人的E2单体结构域;③啤酒酵母的E2单体结构域。L --- N端疏水结构域;B --- E1与E3的结合部位;C --- C端催化活性部位。
1.2丙酮酸脱氢酶系催化的反应机制
目前PDC的功能及作用机理已经研究得比较清楚,其催化丙酮酸氧化脱羧反应的方程式可总结为:丙酮酸+NAD++CoA-SH→乙酰CoA+ CO2 + NADH+ H+。PDC的三种主要成份酶在催化反应过程中以首尾相接的形式发挥作用,首先E1与其辅助因子TPP在α,β亚单位之间的深沟内结合,在Mg2+存在的情况下催化丙酮酸脱羧,形成羟乙基-TPP;然后,羟乙基被移到E2并氧化成乙酰基,乙酰基再与结合上E2的硫辛酸结合形成乙酰硫辛酰胺,接着E2催化乙酰硫辛酰胺上的乙酰基转移给CoA-SH形成乙酰CoA;E3则负责把还原型的硫辛酸氧化形成氧化型的硫辛酸,并把氢传递给FAD,FADH2再使NAD+还原,形成循环(图3)。其中E1是PDC的限速酶。
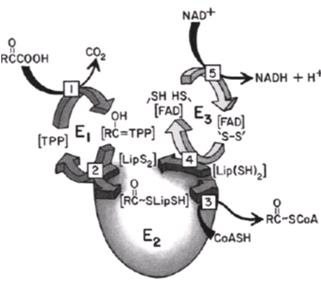
图3 1:E1在TPP与Mg2+的作用下催化丙酮酸脱羧,形成羟乙基-TPP; 2:羟乙基-TPP被移到E2,E2在硫辛酸的作用下催化氧化羟乙基成乙酰基,乙酰基结合上硫辛酸形成乙酰硫辛酰胺; 3:E2催化乙酰硫辛酰胺上的乙酰基转移给CoA形成乙酰CoA; 4:E3把还原型的硫辛酸氧化形成氧化型的硫辛酸,并生成FADH2; 5:在E3的作用下FADH2使NAD+还原,形成循环。
2.丙酮酸脱氢酶系的调节酶
2.1丙酮酸脱氢酶激酶(PDK)
目前对PDK基因的研究大都集中在动物细胞上,动物细胞具有4种形式的PDK,在不同的代谢条件下特异调控PDC。对植物PDK的研究是基于动物PDK的研究进展,目前已在拟南芥、玉米、水稻等植物进行研究,已发现植物有1~2种形式的PDK,其中对拟南芥PDK的研究较多。PDK的同工酶当中,对PDK2的研究比较多,PDK2可分为两部分:N端不保守区域和C端保守区域,催化活性部位在C端(图4-A)。N端部分主要由α螺旋组成;C端部分有既α螺旋又有β折叠,多个β折叠排列构成一个大折叠面,N端部分与C端部分通过α螺旋连接起来。PDK通常以二聚体形式存在,两个单体通过C端的大折叠面相互作用靠在一起,N端朝外,形成有一个中心和两个臂的结构(图4-B)。N端与C端间有一大沟,其大小与形状刚好与PDC的E2亚基N端疏水结构域相吻合,PDK二聚体拥有两个大沟,方向背对朝外,在PDC表面迅速翻移以寻找E2的疏水结构域,当结合上E2亚基上的疏水结构域时,有助于促使二聚体中心部位的暴露而与E1相结合,催化E1磷酸化,阻断丙酮酸到乙酰CoA反应的进行[1]。
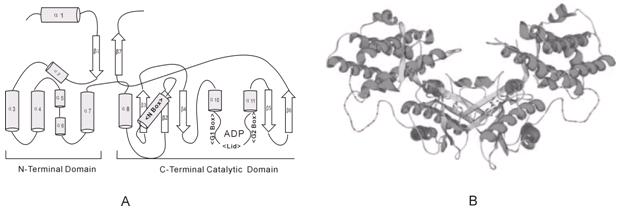
图4: A:PDK单体的二级结构图。 B:PDK二聚体图,青色部分代表α螺旋,黄色部分代表β折叠。
Thelen等[2]对玉米PDK进行了研究,其氨基酸序列大约有37%与哺乳动物的相似,同源性氨基酸残基集中在11个高度保守的不连续区域,其中有5个与原核组氨酸激酶相似,从而称PDK为类组氨酸激酶。在与组氨酸激酶高度相似的5个保守结构域中,一处位于N端,四处位于C端,分别称为:H-box,N-box,D-box ,G1-box和G2-box(图5),其中G1-box和G2-box间的α螺旋主要是疏水性氨基酸,ATP极易与这些分子相结合;N-box是磷酸基团结合部位。当ATP结合在C端的疏水氨基酸基团上时,N-box的磷酸接受基团直接攻击ATP上的γ磷酸基团,使ATP变成ADP,而自身带上磷酸基团[9]。
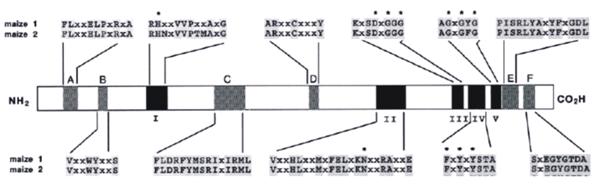
图5: 玉米两个PDK同工酶的保守结构域图。罗马编号Ⅰ~Ⅴ的五个结构域是与原核组氨酸激酶相似的结构域,分别对应H-box、N-box、D-box、G1-box和G2-box;英文编号A~F是真核PDK中特有的六个保守结构域;带星号的氨基酸残基是高度保守的氨基酸残基。
PDK一个明显的调节机制是底物蛋白E1的α亚基三个丝氨酸残基磷酸化,所以PDK是丝氨酸激酶。丝氨酸激酶的活性部位有12个保守的结构域,互相联系形成一个活性催化中心。通过序列分析,PDK缺少上述丝氨酸激酶所要具备的结构域,而拥有5个与细菌组氨酸激酶相似的结构域(H-box,N-box ,D-box ,G1-box和G2-box)。研究表明,哺乳动物、植物、果蝇、线虫等拥有相同的结构[2,3]。在催化反应中,组氨酸激酶先自身磷酸化,磷酸基团受体是位于N端的组氨酸残基,然后再将磷酸基团转移到底物蛋白的天冬氨酸残基或谷氨酸残基。PDK的催化机理与组氨酸激酶的催化机理相似,在催化反应中,有多处组氨酸残基参与转移磷酸基团,但其催化底物的磷酸接受基团是丝氨酸残基[1-5]。与E2的结合能提高PDK的酶活,用游离的PDK催化游离的E1的磷酸化反应速度要比PDC复合体状态的E1的磷酸化速度低10倍。这是由于PDK通过大沟紧密结合在PDC复合体E2亚基N端的疏水结构域上,结合上E2的PDK其催化中心充分暴露,从而使激酶活性增强[1,6]。
2.2丙酮酸脱氢酶磷酸酶(PDP)
PDP是定位于线粒体上的丝氨酸/苏氨酸磷酸酶,负责催化已磷酸化的PDH去磷酸化从而使PDH恢复活性。PDP的催化机制在许多地方与PDK有着相似之处,它与E2的结合不如PDK那样紧密,但仍然比游离的PDP去磷酸化速度提高约10倍。PDP与E2的结合部位也是E2的N端的疏水结构域,其活性的发挥需要硫辛酰基以及二价阳离子的参与[2,5,8]。目前对植物PDP的研究少见报道。
3、PDK在分子生物学上的研究进展
由于PDC催化的反应不可逆, PDK作为PDC的负调控酶,在新陈代谢调节中起着极其重要的作用。有关PDK的研究大多集中在动物中,如哺乳动物。近年来在植物中的研究陆续进行,主要集中在拟南芥和玉米,在水稻中的研究近两年才见有报道。近年研究发现,哺乳动物有4种PDK同工酶,玉米、水稻等有2种PDK同工酶,拟南芥有1种PDK。
基于哺乳动物PDK的研究,现已克隆到多种植物的编码PDK的cDNA。Thelen等[2]从玉米中克隆到两个PDK同工酶基因。PDK1与PDK2有77%的氨基酸相似性;玉米PDK与拟南芥PDK约有70%的氨基酸相似性;玉米PDK与哺乳动物PDK约有37%的氨基酸相似性。通过序列分析,玉米PDK含有11个高度保守的结构域。通过RT-PCR反应发现,PDK1与PDK2的表达模式不一样,PDK1在生长发育的整个过程保持大量表达,而PDK2只在绿叶中有较高的表达量,在其它部位微量表达或不表达,可能是绿叶在光合作用时合成大量的ATP刺激PDK2的表达。
利用反义技术部分抑制拟南芥PDK的表达,其结果是PDK的表达量下降,PDC活性增加,同时转基因植物改变其生长表形:植物生长产率提高了,种子重量及含油量增加,营养器官的养分积累减少、花期提前、生活周期缩短等,并且,实验数据表明,在未成熟的种子中,mtPDC与脂肪酸的合成有关。通过免疫印迹,利用拟南芥PDH的α亚基的单基隆抗体作探针,Zou等[4]得到的结果是反义抑制PDK表达的转基因拟南芥其PDH的α亚基的表达量并没有比野生型的高,认为PDC活性的增强并不是PDH蛋白表达量的增加,而是取决于其活性调节酶PDK的表达水平。李静、Jan等[7]研究发现水稻有两个PDK基因:两者的核酸序列相似性为82%,氨基酸序列相似性为83%。研究表明两个PDK基因具有不同的生物学功能。PDK1在叶部表达量较高,PDK2在各个器官都有较高的表达量。构建反义表达载体部分抑制PDK基因的表达,得到以下结果:反义PDK1后代性状变化主要发生在叶片,表现为分蘖减少、叶色变浅、发育迟缓以及生育期处长;反义PDK2后代性状变化主要发生在穗部,表现为抽穗期提前、花粉育性下降、结实率下降、株高变低以及生育期缩短。另外,GA能上调PDK1的表达,从而下调PDC的活性,而其它激素(2,4-D,BA,BL等)对PDK1的表达基本无影响[7]。
4、结语
在近20多年的研究中,对PDC、PDK的研究有了很大的进展。但是植物细胞PDC的很多方面都还没有揭示清楚,例如PDC的天然结构和特性还不是很清楚,PDH的活性范围波动很大,其自然变异程度也很高。目前掌握的植物PDK的信息还比较少,譬如动物细胞具有4种形式的PDK,而植物细胞中只有一到两种,那么植物中的PDK 又是怎样起充分调控PDC活性作用的呢?对植物PDP结构方面的认识几乎一片空白。总之,这些问题还有待人们进一步深入的探讨。
相关热词搜索:丙酮酸脱氢酶
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

