|
摘 要:从土壤中分离筛选出5株产胞外β-甘露聚糖酶的菌株,其中DK3菌株的摇瓶培养液的酶活力达3.85 U /ml。该酶水解葡甘露聚糖的最适温度为37℃,最适pH为6.0,pH稳定范围为5.0~9.0 ,在低于40℃的温度下基本稳定。Fe 2+ 、Cu2+、EDTA和NH4+ 对该酶有抑制作用,Na+ 则有激活作用。
关键词: β-甘露聚糖酶;筛选;酶学性质
β-1,4-D-甘露聚糖酶(β-1,4-D-mannan mannanohydrolase,EC.3.2. l. 78)是一类能水解含有β-1,4-D-甘露糖为主链的多糖(包括甘露聚糖、半乳甘露聚糖、葡甘聚糖等)的内切酶[1]。该酶用途广泛,能分解魔芋葡甘露聚糖,生产能促进双歧杆菌生长、改善肠道菌群结构的魔芋低聚糖;可作为工具酶用于天然多糖类结构的分析;在造纸工业中,与β-木聚糖酶等半纤维素降解酶类协同使用,能除去纸浆中的半纤维素,改善纸质;在纺织工业中用于纤维中半纤维素的降解,能有效去除纺织品所粘附的多余染料;在饲料工业中用作酶添加剂,起到消除抗营养因子的作用[2-4]。虽然β-甘露聚糖酶的应用前景广阔,但目前总的来说,其低产和高成本限制了其应用范围和规模,能改变这种状况的最重要的途径之一是筛选和培育产高活力β-甘露聚糖酶的高产菌株。
1 材料与方法
1.1 土壤来源
土壤样品从广西大学农场甘蔗地、广西南丹县魔芋种植地和南宁绿源肥料厂堆肥地采集。
1.2 试剂
葡甘露聚糖(商品名:魔芋精粉)购自武汉市清江魔芋制品有限公司。
其它试剂均为分析纯试剂。
1.3 培养基
富集培养基(%):魔芋精粉2.0,酵母膏0.5,蛋白胨0.3,NaCl 0.5;
固体分离培养基(%):魔芋精粉1.0,NaNO3 0.3,MgSO4·7H2O 0.5,KCl 0.5, K2HPO4 0.1,FeSO4·7H2O 0.001,琼脂 1.0,pH6.0;
发酵培养基(%):魔芋精粉1.0,酵母膏0.5,蛋白胨0.3,NaNO3 0.3,MgSO4·7H2O 0.5,KCl 0.5,K2HPO4 0.1,FeSO4·7H2O 0.001,pH6.0;
产酶培养基(%):魔芋精粉1.0,NaNO3 0.3,MgSO4·7H2O 0.5,KCl 0.5,K2HPO4 0.1,FeSO4·7H2O 0.001,pH6.0。
1.4 菌株的分离和筛选
称取1 g土壤于试管中,加入l0ml蒸馏水,振荡混匀,取l ml接种到富集培养基中,37℃,160 rpm培养24 h。选择培养液粘度明显下降的菌液,用无菌水梯度稀释后涂布于固体分离培养基中,置 37℃培养箱中培养24 h,用刚果红染色,观察菌落周围有无透明圈,挑取透明圈大的单菌落进行划线纯化。经纯化后的菌株在发酵培养基中培养24 h,测定培养液中β-甘露聚糖酶的活力,筛选出酶活力高的菌株。
1.5 β-甘露聚糖酶粗酶液的制备
将菌株接种于发酵培养基中,37℃培养24 h,按l %比例接入产酶培养基中,37℃,160 rpm培养24 h。发酵液离心所得上清液即为粗酶液。
1.2.4 β-甘露聚糖酶酶活力的测定
酶活力的测定:取0.4 ml 0.5%(w/v)葡甘露聚糖 (用pH7.0,0.01 mol/L 磷酸钠缓冲液配制),加入0.1 ml 适当浓度的酶液,37℃水浴反应15 min,用DNS法测定所产生的还原糖[7]。
酶活力单位定义:在上述反应条件下,每分钟由底物释放出相当于1µmolD-甘露糖的还原糖所需酶量为1个酶活力单位(U)。
2 结果
2.1 菌株筛选
从土样中筛选出5株产β-甘露聚糖酶的高产菌株(编号为DK1~5),其中DK3菌株的摇瓶培养液的粘度下降快,菌落周围有大的透明圈,摇瓶培养液中的β-甘露聚糖酶活力达3.85 U /ml (表1)。
表1 菌株筛选结果
|
菌株编号 |
β-甘露聚糖酶活力(U / ml) |
|
DK1
DK2
DK3
DK4
DK5 |
2.21
2.42
3.85
3.30
3.00 |
2.2 酶学性质的研究
2.2.1 温度对酶活力的影响:在30~70℃下测定β-甘露聚糖酶的活性,结果表明,该酶分解葡甘露聚糖的最适温度为37℃,在30~45℃都具有较高的活力(图1)。
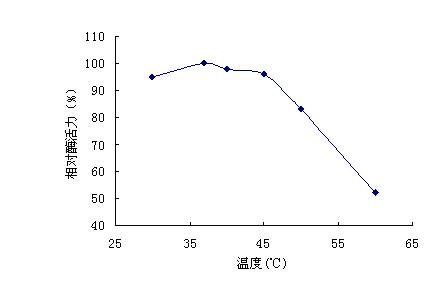
图1 β-甘露聚糖酶促反应最适温度
2.2.2 温度对酶稳定性的影响:将酶液分别置于40、50、60℃恒温水浴中处理,每隔20 min取样,测定残留酶活力(以未经处理的酶液作对照)。结果表明,该酶在40℃下相对稳定(图2)。
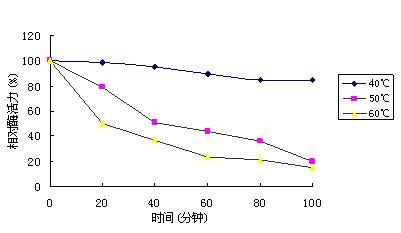
图2 β-甘露聚糖酶的温度稳定性
2.2.3 pH对酶活力的影响:配制pH3.0-6.0,0.01mol/L Na 2HPO4-0.005mol/L柠檬酸缓冲液,pH 7.0-8.0,0.025 mol/L磷酸盐缓冲液和pH9.0-10.0,0.05 mol/L甘氨酸-氢氧化钠缓冲液为酶促反应缓冲液,测定不同pH值下的酶活力。结果表明,酶促反应的最适pH为6.0(图3)。
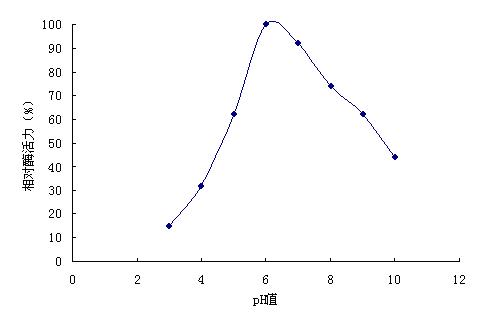
图3 β-甘露聚糖酶促反应最适pH值
2.2.4 pH对酶稳定性的影响:将酶液与上述不同pH的缓冲液混合,37℃静置1h后,调pH至6.0,测定酶活力。结果表明,该酶在pH 5.O~9.0相对稳定(图4)。
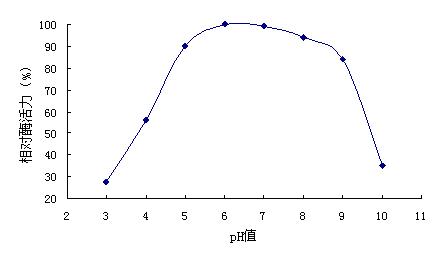
图4 pH对β-甘露聚糖酶活力的影响
2.2.5 金属离子和EDTA对酶活力影响:将1mmol/L的溶液与酶液等量混合,37℃保温60min,测定酶活力。结果表明,Fe 2+ 、Cu2+对酶有强烈的抑制作用,EDTA有较强的抑制作用,NH4 +、Mg2+对酶有较弱的抑制作用,Na+对酶则有较小的激活作用(表2)。该结果与陈一平[6]的结果相似,不同之处在于该酶也受Cu2+强烈抑制,实验结果表明该酶的活性中心可能含有巯基,由于EDTA对该酶的抑制较强,所以推测其酶活性需要某种二价金属离子。
表2 化学试剂对β-甘露聚糖酶活力的影响
|
试剂(1mmol/L) |
相对酶活力(%) |
|
-----
CuSO4
EDTA
MgSO4
FeSO4
(NH4)2SO4
NaCl |
100
18
40
75
17
80
108 |
3 讨论
据报道,魔芋低聚糖促进双歧杆菌生长效果优于乳果糖、大豆低聚糖及低聚异麦芽糖等低聚糖[8]。因此,β-甘露聚糖酶最有应用前景的用途之一是用于魔芋低聚糖的生产。但是,其应用于工业生产的前提是生产出低成本的高活力酶。本研究所筛选到的菌株在培养24h后,其培养液中的β-甘露聚糖酶活力即接近最高值,培养时间比国内其他文献[ 2-3 ]所报道的明显缩短。此外,该酶属胞外酶,易于提取,酶活力达3.85U /ml,稍高于国内一些文献的报道[9]。但总的来说该酶的制备成本还太高,离实际应用的要求还有相当长的一段距离。今后除了需要进一筛选活力更高、稳定性更好的菌种之外,还应该开展固定化细胞法生产胞外β-甘露聚糖酶和固定化酶法生产魔芋低聚糖的研究,以降低生产成本。
参 考 文 献
[1] Schimbug D., Salmann M. Enzyme handbook(4). Springer-Verlag Berlin Heideberg, 1991, 1-5.
[2] 杨文博,沈庆,佟树敏.产β-甘露聚糖酶地衣芽孢杆菌的分离筛选及发酵条件,微生物学通报,1995,22(3):54-157.
[3] 崔福绵,石家骥,鲁茁壮.枯草芽孢杆菌中性β-甘露聚糖酶的产生与性质,微生物学报,1999,39(1):60-63.
[4] 田亚平,金其荣.黑曲霉β-甘露聚糖酶酶学性质及其化学组成.无锡轻工大学学报,1998,17(3):31-35.
[5] Viikari L.Kantelinen A,Ratto M a1.Enzyme in Biomass ConversationAmerian Chemial Society, 1991: 11-21.
[6] 陈一平,龙健儿等.β-甘露聚糖酶产生菌的筛选和发酵条件的初步研究,天然产物研究与开发,10 (3):24-28.
[7] Akino T,Nakamura N, Horiroshi K . Agric Biol chem.,1988,52:773-779.
[8] 向进乐,陈文品,刘勤晋.魔芋低聚糖的研究进展,中国食品添加剂,2004 No.1.
[9] 杨幼慧, Alan M McKAY.β-甘露聚糖酶的产酶菌种、条件及部分性质研究,华南农业大学学报,2001,22(2):86-88. | 




