酿酒酵母发酵生产S-腺苷甲硫氨酸工艺的优化
2009-04-20 22:52:25 来源:本站原创 评论:0 点击:
| 李海军,朱希强*,刘彩霞,郭学平,凌沛学 (山东省药学科学院,国家糖工程研究中心,山东 济南 250108) |
|
摘 要:目的 优化酿酒酵母LS101发酵生产S-腺苷甲硫氨酸(SAM)的工艺。方法 用单因素实验法,通过测定SAM浓度、细胞浓度、胞内SAM含量以及胞外SAM浓度等参数来确定较为适合的工艺。结果 得到适合的培养基组成为:蔗糖10 %~12 %,L-甲硫氨酸0.4 %,尿素1.5 %~2 %,酵母粉3 %,甘氨酸0.1 %,生物素4 mg/L。8 L发酵罐间歇分批补料发酵,培养54 h后SAM产量为3.9 g/L,细胞浓度达到42.2 g/L。结论 得到了优化的酿酒酵母LS101生产SAM发酵工艺,提高了SAM发酵水平。
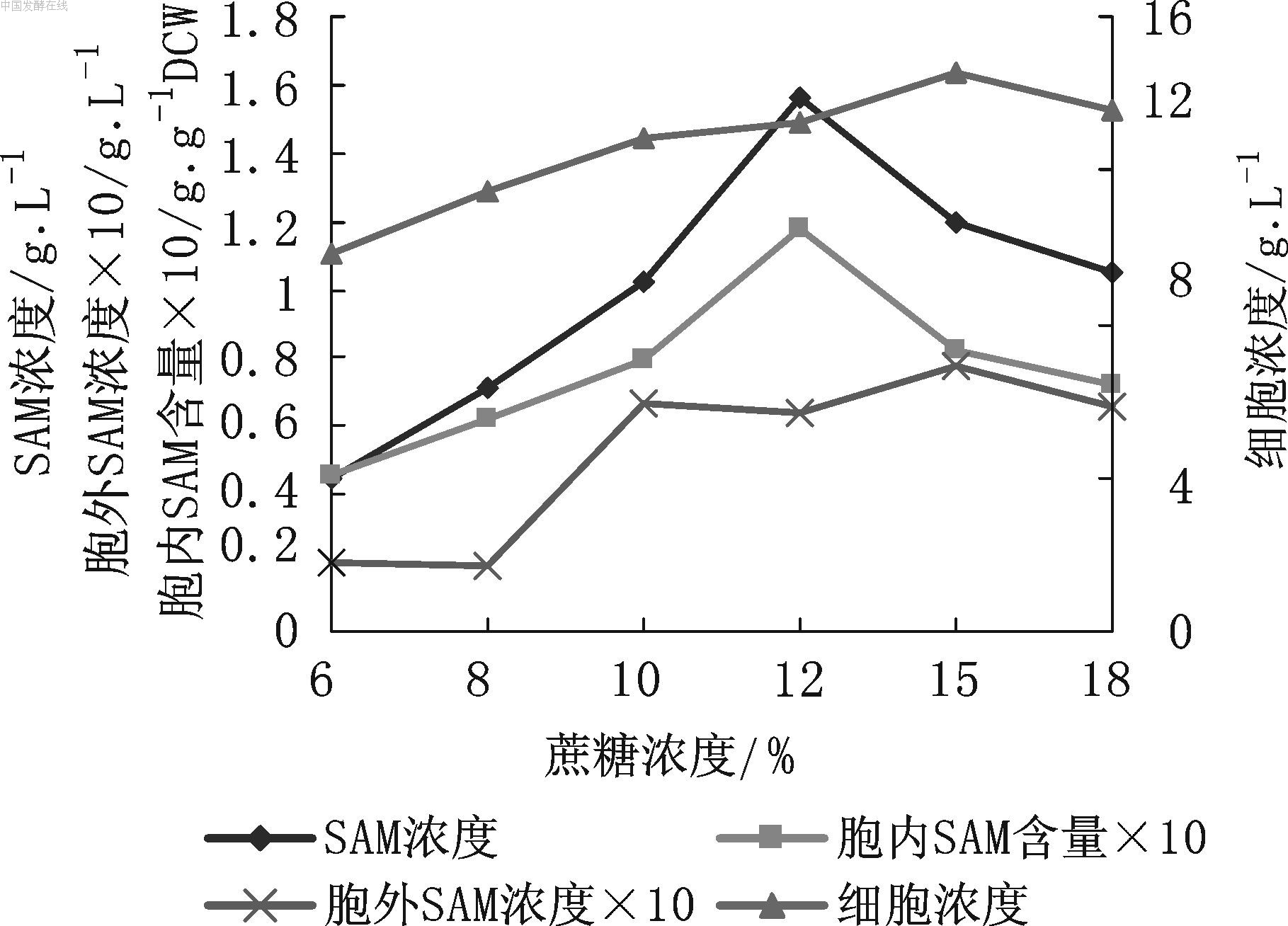
S-腺苷甲硫氨酸(S-adenosylmethionine,SAM),是存在于所有生物体活细胞中的重要代谢中间体,1952 年首先由Cantoni[1]发现。在体内,SAM由ATP和L-甲硫氨酸经甲硫氨酸腺苷转移酶[EC2.1.5.6] 催化合成。SAM能参与体内约35的种生化反应,是人体内最重要的甲基供体,并具有转硫和转氨丙基的作用[2]。20 世纪70年代后期,SAM 在欧洲是一种治疗抑郁症的针剂处方药。1990年美国FDA通过了SAM 的随机双盲法验证,1996 年批准柜台销售,1999 年SAM口服肠衣片和软胶囊成为美国畅销的营养保健品。多年的应用研究证明,SAM 对肝病、抑郁症、痴呆症、关节炎和空泡脊髓炎等疾病的治疗效果显著 [3]。我国SAM的开发尚处于起步阶段,对SAM的研究具有十分重要的意义。SAM的生产制备方法主要有化学合成法、发酵法和酶促转化法3种。在培养基中加入前体L-甲硫氨酸,酵母发酵合成SAM是目前主要的工业生产方法[4]。国内多家机构研究酿酒酵母发酵生产SAM [5-10],但目前尚处于实验室水平或工业化生产的初级阶段,国内尚无规模化生产的报道。本实验室对SAM发酵条件进行了优化研究。 1 材料 1.1 菌种及标准品 SAM高产菌株酿酒酵母LS101,由本实验室筛选保藏。 SAM 标准品(Sigma公司) 1.2 仪器 UV-2100型紫外分光光度计(上海尤尼柯仪器有限公司);Agilent 1100型高效液相色谱仪(美国安捷伦科技公司);TGL-20B-C高速台式离心机(上海安亭科学仪器厂);GBJT-7W型全自动发酵系统(镇江东方生物工程设备技术公司)。 1.3 培养基 保藏培养基(/L):蔗糖20 g,酵母粉10 g,KH2PO4 4 g,K2HPO4•H2O 2.6 g,MgSO4•7H2O 0.1 g,ZnSO4•7H2O 2.5 mg,MnSO4•4-6H2O 12.5 mg;pH自然;115 ℃下灭菌20 min;保藏菌种时加入20 %~30 %甘油,-20 ℃冷冻保藏。 种子培养基(/L):蔗糖50 g,酵母粉 10 g,KH2PO4 4 g,K2HPO4•3H2O 2.6 g,MgSO4•7H2O 0.1 g,ZnSO4•7H2O 2.5 mg,MnSO4•4-6H2O 12.5 mg;pH 6.0;115 ℃下灭菌20 min;固体培养基添加2 %琼脂。 摇瓶及发酵罐培养基(/L):蔗糖、酵母膏、尿素适量,L-甲硫氨酸 4 g,CaCl2 0.2 g,少量的磷酸盐和其他无机盐;pH自然;115 ℃下灭菌20 min。 2 方法 2.1 种子培养与发酵 二级种子培养:将冻藏种子接种到含有25 mL种子培养基的250 mL摇瓶中,温度30 ℃,200 r/min培养24 h,作为一级种子;按1 %~5 %的体积比将一级种子接种到种子培养基中,30 ℃,200 r/min培养12~24 h ,作为二级种子。 摇瓶发酵:5 mL种子接入含有100 mL发酵培养基的500 mL摇瓶中,温度30 ℃,220 r/min发酵。 发酵罐间歇分批补料发酵:取摇瓶培养的二级种子,按发酵罐工作体积的5 %~10 %接种到8 L全自动控制发酵罐中。调节转速和空气流量控制溶氧在30 %以上,发酵过程中流加NaOH控制pH 5.0左右,培养温度30 ℃,定时补加蔗糖和L-甲硫氨酸。 2.2 细胞浓度测定 1 mL发酵液离心得沉淀,沉淀的细胞用蒸馏水重悬,然后稀释到一定倍数,使A600nm 在0.2~0.8 之间,根据细胞浓度CX(菌体干重)与A600nm的工作曲线计算细胞浓度。 2.3 SAM浓度测定 本实验测定胞内SAM浓度和胞外SAM浓度,以每 克菌体干重(DCW)所含胞内SAM的克数作为胞内SAM含量(g/g)。 在3 mL 发酵液离心后的菌体中加入3 mL 1.5 mol/L 的HClO4,提取1 h 后离心,在菌体中再加入3 mL 1.5 mol/L 的HClO4 提取1 h,离心后合并上清,稀释一定倍数,HPLC分析得到胞内SAM浓度;稀释发酵液离心后的上清,HPLC检测得到胞外SAM浓度。 Diamonsil C18色谱柱(4.6 mm×250 mm,5 μm),流动相为:甲醇∶0.04 mol/L NH4H2PO4 +0.008庚烷磺酸钠(18∶82),柱温35 ℃,流速1 mL/min,254 nm 紫外检测。与SAM标准品比较计算SAM浓度。 2.4 蔗糖浓度测定 用改进后的DNS法测量蔗糖浓度。取1 mL 发酵液离心的上清,加入0.2 mL 6 mol/L盐酸沸水浴10 min,使蔗糖充分水解成还原糖。NaOH调水解液至中性,然后用DNS法测量还原糖浓度,对照绘制的标准曲线得到蔗糖的含量。 3 结果与讨论 3.1 蔗糖浓度 酿酒酵母合成SAM一般选用蔗糖为碳源。初始发酵液中蔗糖终浓度分别为6 %,9 %,12 %,15 %,18 %,酵母粉浓度为1 %,尿素浓度为1.5 %(过滤除菌,接种前单独加),其他条件同1.3和2.1。摇瓶发酵72 h,结果见图1。
图1 蔗糖浓度对SAM发酵的影响 由图1可见, 蔗糖浓度6 %~12 %的范围内,SAM浓度和胞内SAM含量逐渐增加,12 %时到达最高[1.56 g/L和0.118 g/g(DCW)],胞外的SAM浓度也较高。蔗糖浓度继续升高,SAM合成量开始下降,可能是较高的糖浓度抑制了甲硫氨酸腺苷转移酶的活性。酵母利用蔗糖的速度较快,48~72 h时,所有发酵液中残留的蔗糖已少于5 g/L。因此,选用10 %~12 %的糖浓度较适宜。
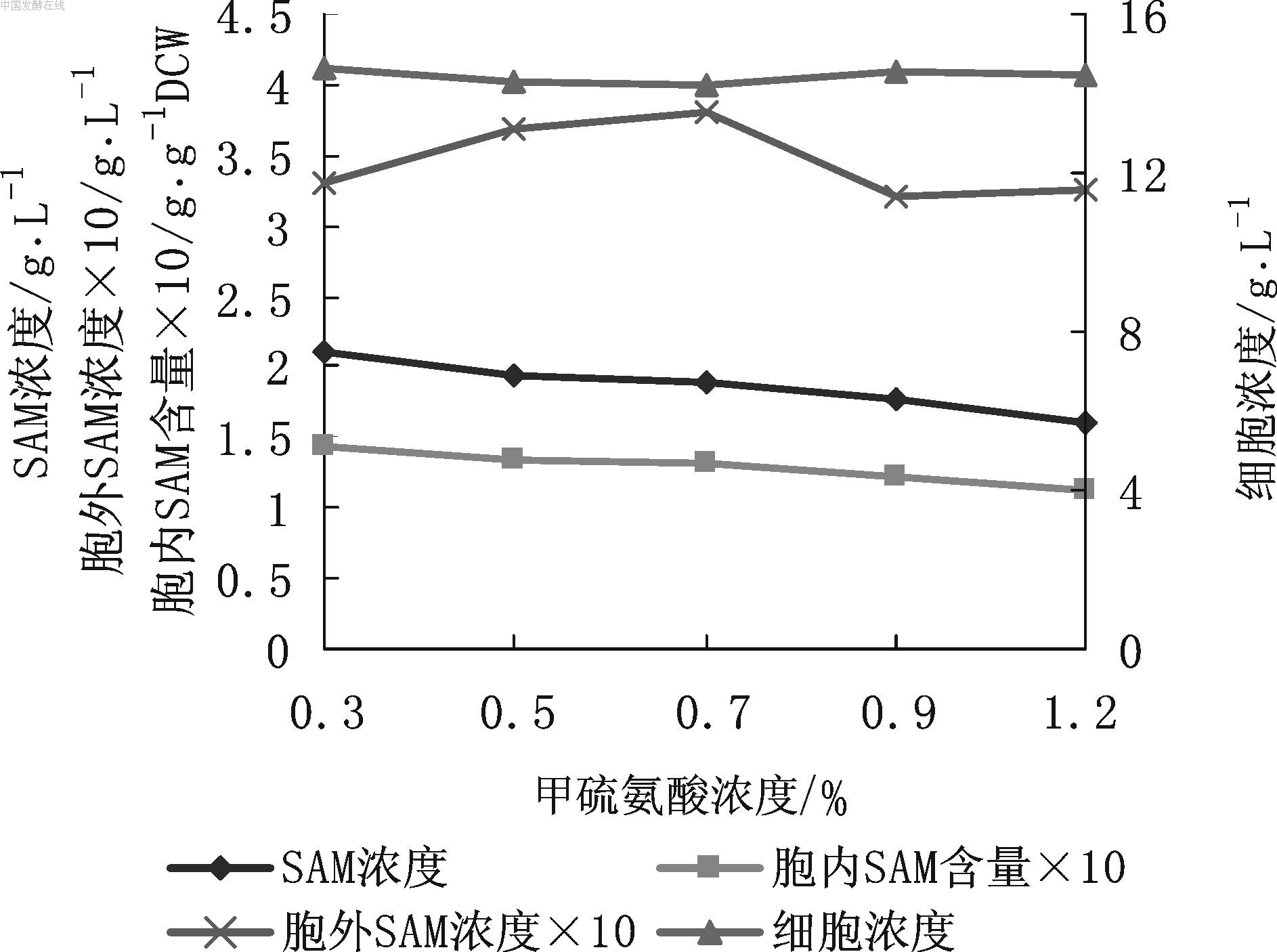
图2 L-甲硫氨酸浓度对SAM发酵的影响 由图2可见,SAM积累浓度随着发酵液中L-甲硫氨酸浓度的增加呈明显下降的趋势,从2.11g/L减至1.61 g/L;胞内SAM含量也呈相同的变化,从0.144 g/g DCW降至0.112 g/g DCW,但胞外SAM浓度和细胞浓度基本无变化。表明过高的L-甲硫氨酸浓度对甲硫氨酸腺苷转移酶有明显的抑制作用,导致SAM合成减少,因此应适当减低L-甲硫氨酸浓度。实验表明,L-甲硫氨酸浓度0.3 %~0.5 %较适宜,一般选用0.4 %,既不会明显抑制SAM合成,也能积累较高浓度的SAM。
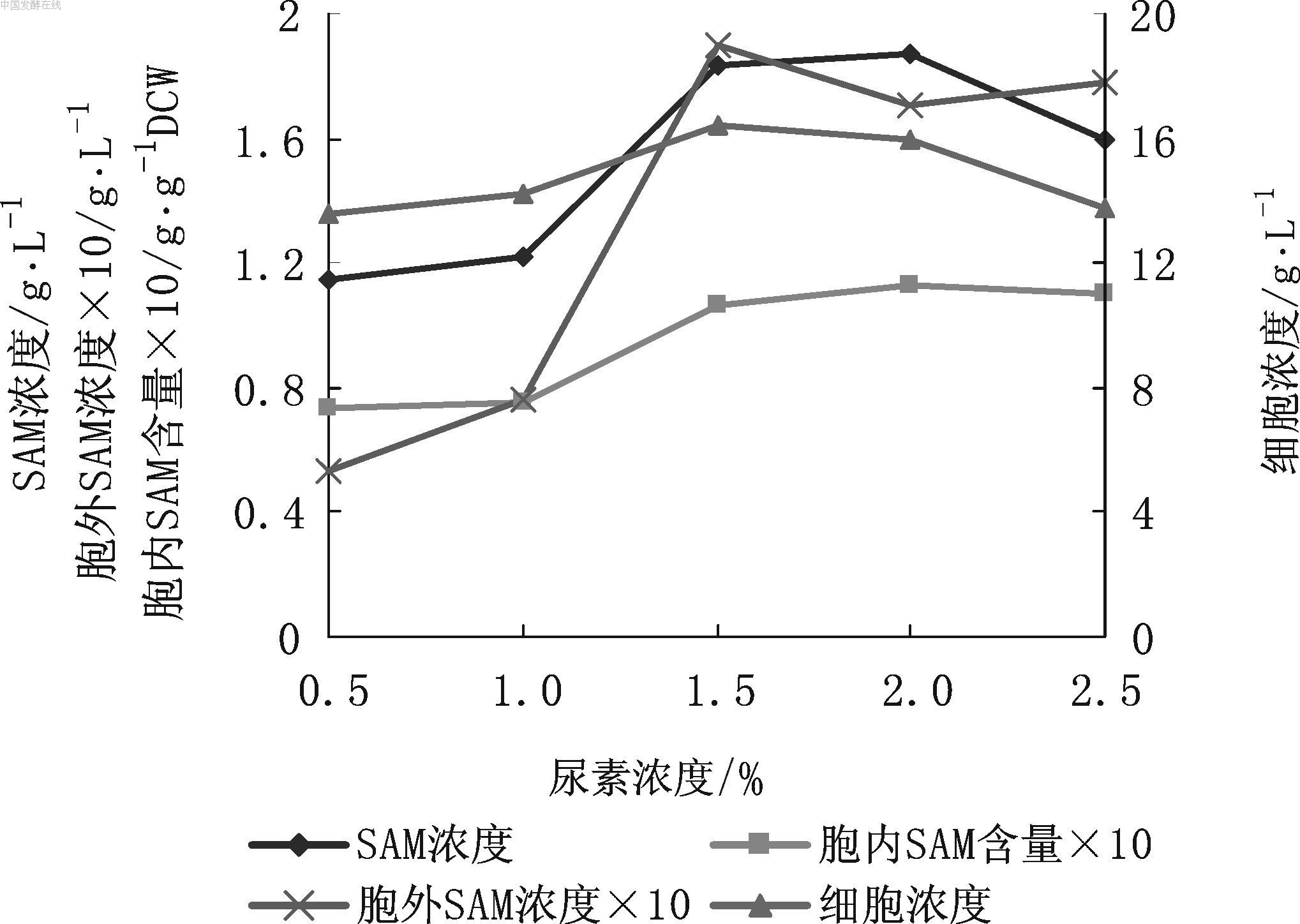
图3 尿素浓度对SAM发酵的影响 3.4 酵母粉浓度对SAM发酵的影响
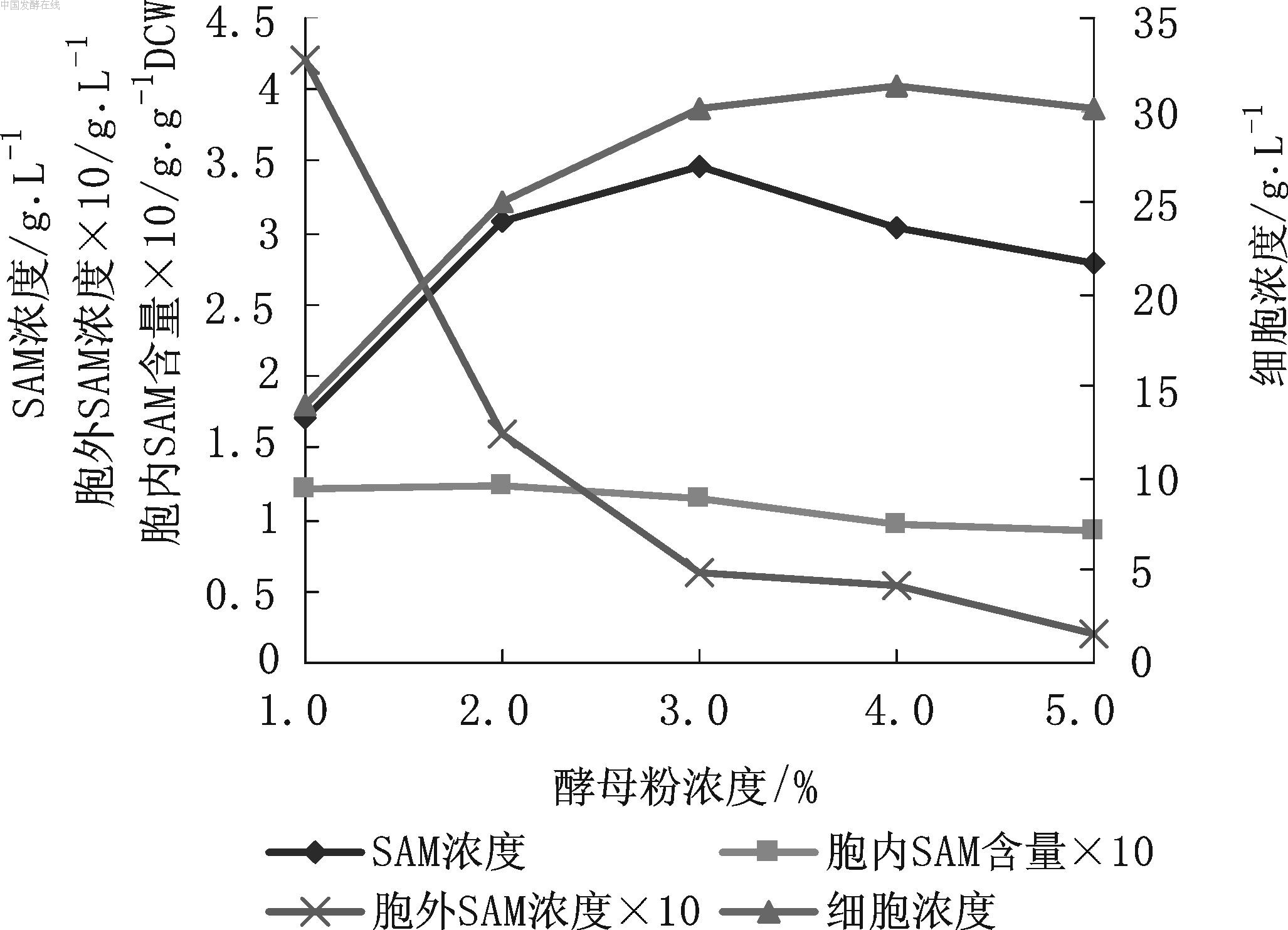
图4 酵母粉浓度对SAM发酵的影响 由图4可见,酵母粉浓度对SAM的合成有很大的影响。酵母粉浓度从1 %增至3 %时,SAM浓度从1.70 g/L 提高到3.47 g/L,增加了104.1 %;细胞浓度由14.06 g/L提高到30.17 g/L,增加了114.6 %;胞内SAM含量基本无变化,而胞外SAM浓度急剧减少,可能是因营养充足,细胞死亡破碎较少,这对于SAM后提取工艺有重要意义。但酵母粉浓度从3 %增至5 %时,细胞浓度基本没有变化,同时SAM浓度和胞内SAM含量均呈下降趋势。故选用3 %酵母粉浓度。发酵液中的蔗糖在48 h时已全部耗尽,此时分析发酵液中乙醇浓度较高。至发酵结束时,乙醇浓度逐渐减少。
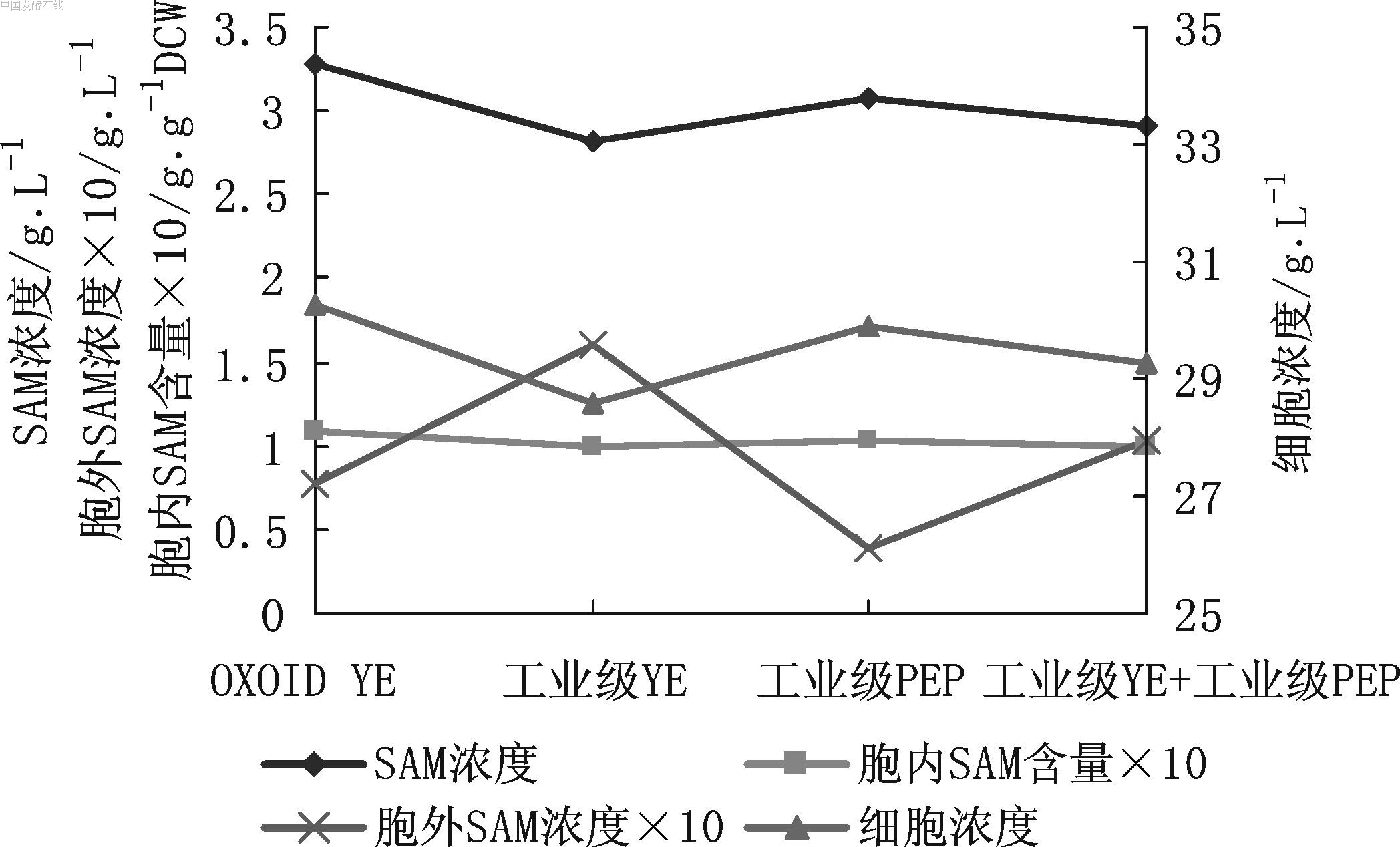
图5 4种有机氮源对SAM发酵的影响 YE: 酵母粉,PEP: 蛋白胨 由图5可见,Oxoid酵母粉的发酵结果略好于其他3种有机氮源(3.29 g/L vs 3.0 g/L),细胞浓度以及胞内SAM含量也稍高,但差别不大。工业级蛋白胨与Oxoid最为接近。考虑成本控制,可用工业级酵母粉或蛋白胨。
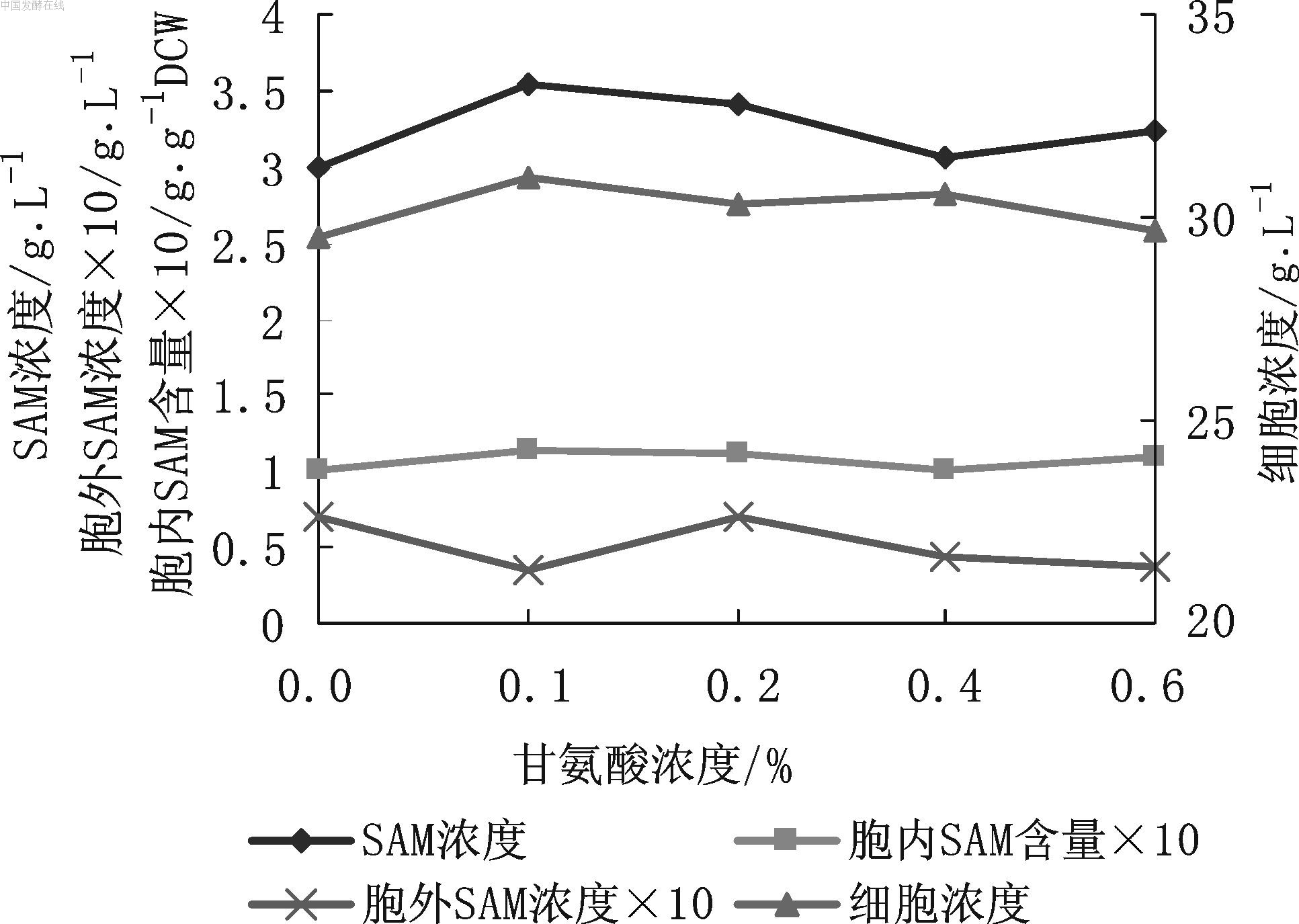
图6 甘氨酸浓度对SAM发酵的影响 由图6可见,添加0.1 %甘氨酸,SAM的浓度从2.98 g/L提高至3.54 g/L,胞内SAM含量从0.101提高至0.114,胞外SAM浓度也较低。甘氨酸浓度大于0.1 %时,SAM浓度反而小幅下降。添加甘氨酸对酵母细胞生长基本没有影响,故选用0.1 %甘氨酸浓度。
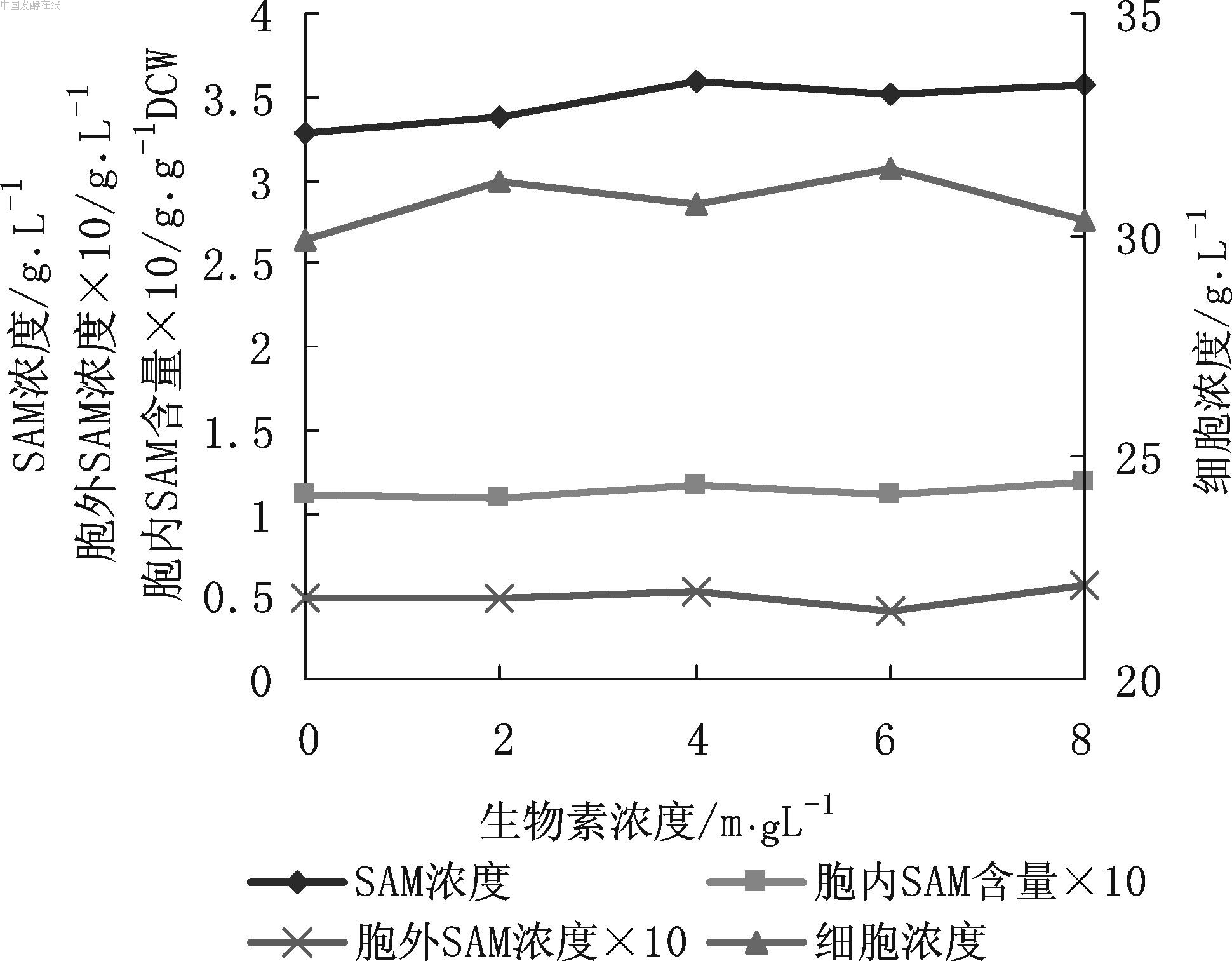
图7 生物素浓度对SAM发酵的影响 由图7可见,添加一定量的生物素后,SAM浓度和细胞浓度都有小幅升高,生物素浓度4 mg/L时SAM浓度最高(3.6 g/L);而胞内SAM含量和胞外SAM浓度变化不大。因而选用4 mg/L生物素浓度。
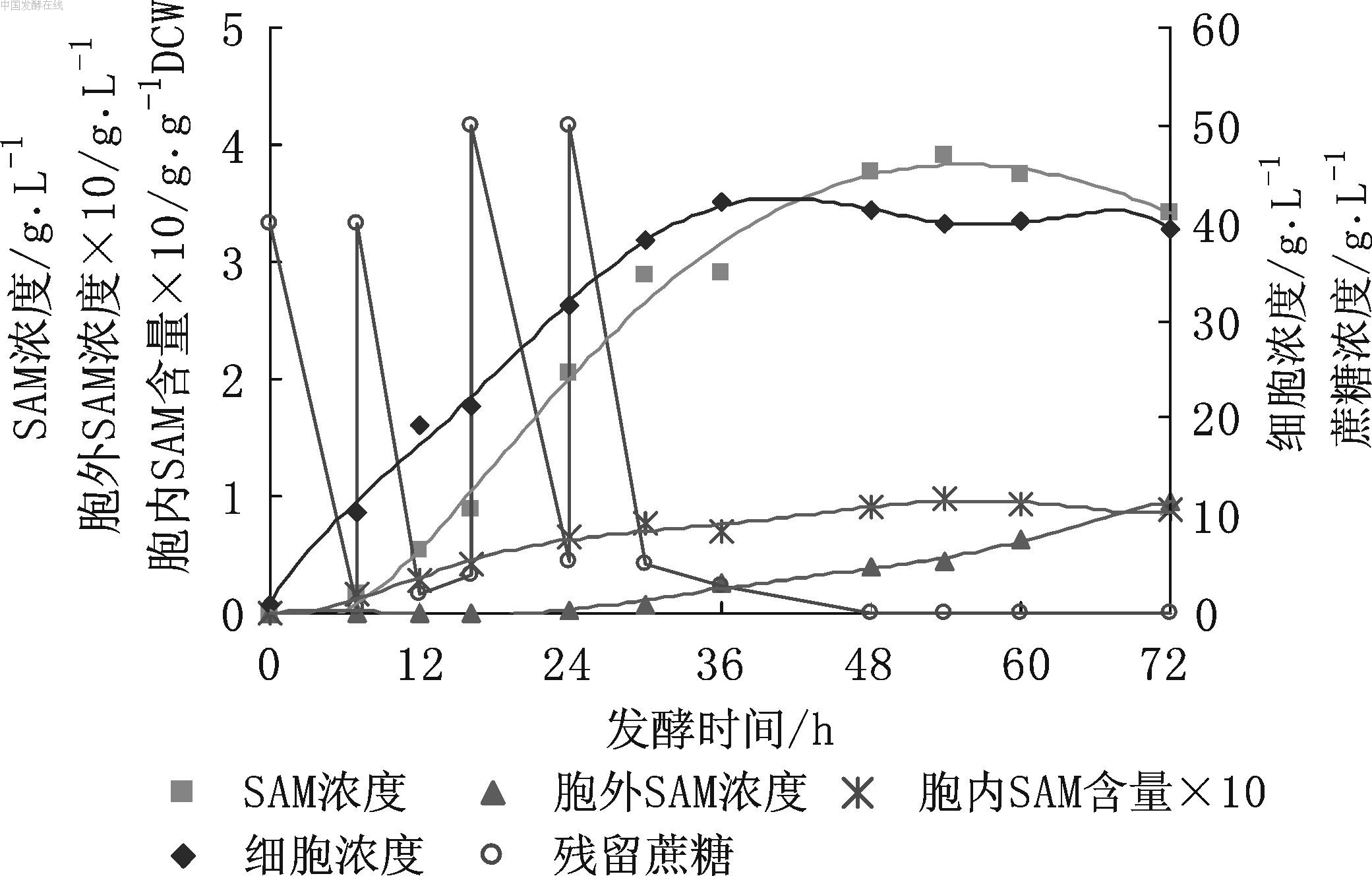
图8 8 L发酵罐上间歇分批补料时SAM的发酵情况 在上述实验基础上,以8 L发酵罐间歇分批补料发酵。补料策略为:尽量降低蔗糖和L-甲硫氨酸对SAM合成酶的抑制,分批定时补加蔗糖和L-甲硫氨酸。蔗糖补加过程为:发酵液初始蔗糖40 g/L,分别于8,16,24 h补加40,50,50 g/L,蔗糖用量总计为180 g/L;L-甲硫氨酸补加过程为:发酵液L-甲硫氨酸4 g/L,分别于16,24,30 h补加1.5,1.5,1.5 g/L, L-甲硫氨酸总计用量为8.5 g/L。其他发酵条件见2.1与3.7,发酵72 h,实验结果见图8。 参考文献 |
上一篇:胸腺嘧啶新的生物合成路径
下一篇:猪流感疫苗的研究进展
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)