氨基酸营养缺陷型突变株的筛选
2007-12-27 22:31:01 来源:郑州轻工业学院 评论:0 点击:
了解营养缺陷型突变株选育的原理。
学习并掌握细菌氨基酸营养缺陷型的诱变、筛选与鉴定方法。
二、基本原理
营养缺陷型是指野生型菌株由于某些物理因素或化学因素处理,使编码合成代谢途径中某些酶的基因突变,丧失了合成某些代谢产物(如氨基酸、核酸碱基、维生素)的能力,必须在基本培养基中补充该种营养成分,才能正常生长的一类突变株。这类菌株可以通过降低或消除末端产物浓度,在代谢控制中解除反馈抑制或阻遏,而使代谢途径中间产物或分支合成途径中末端产物积累。在氨基酸、核苷酸生产中已广泛使用营养缺陷型菌株;也可用于遗传学分析、微生物代谢途径的研究及细胞和分子水平基因重组研究中作为供体和受体细胞的遗传标记(如鼠伤寒沙门氏菌组氨酸和生物素缺陷型的突变株TAl535:his-,bio-,ΔuvrB,rfa)。
营养缺陷型筛选一般分四个环节,即诱变剂处理、营养缺陷型浓缩、检出和鉴定。诱变处理突变频率较低,只有通过淘汰野生型,才能浓缩营养缺陷型而选出少数突变抹。浓缩营养缺陷型有青霉素法、菌丝过滤法、差别杀菌法和饥饿法四种。检出营养缺陷型也有逐个测定法、影印培养法、夹层培养法和限量补给法四种。鉴定营养缺陷型一般采用生长谱法。
本实验选用亚硝基胍(NTG)为诱变剂,在碱性时NTG 能形成重氮甲烷(CH2N)、烷化DNA 而使基因突变:pH 5~ 5.5 时,NTG 形成HNO2,本身也是诱变剂;pH 6.0 时,NTG 本身不变化,可作用于核蛋白而引起诱变效应。NTG 是—种超诱变剂,杀菌力较弱,诱变作用较强,其作用部位又往往在 DNA的复制叉处,易造成双突变。一般选用NTG 处理时,诱变频率较高,可使百分之几十的细菌发生营养缺陷型突变,筛选营养缺陷型时,可省去浓缩缺陷型这一环节
三、实验材料
(一) 菌种
棒杆菌T6-13(谷氨酸产生菌)。
(二) 培养基 配制法见附录。
1. 细菌完全培养基(简称CM)
固体和液体。
2. 细菌基本培养基(简称MM)
固体和液体。
3. 无氮基本培养基
在基本培养基中不加(NH4)2SO4(液体)。
4. 2 倍氮源基本培养基
在基本培养基中加入2 倍(NH4)2SO4(液体)
5. 补充培养基(简称SM)
为满足某特定营养缺陷型菌株的营养要求而在基本培养基中加入某—种或几种营养成分的培养基称补充培养基。
注:配制基本培养基的药品均用分析纯,使用的器皿应洁净,需用蒸馏水冲洗2~3 次,必要时用重蒸水冲洗。
琼脂是从一种海藻中提取的聚半乳糖的的硫酸酯,除含少量的钙、镁、钠、钾等矿物质外,还含有少量蛋白质、维生素等营养成分,需用洗涤处理过的琼脂,否则会影响营养缺陷型的筛选结果。洗涤琼脂的方法有两种:
(1) 将500 g 琼脂放于大玻璃缸内,加5 L 蒸馏水和500 mL 氮苯浸泡24 h,然后滤去氮苯液和水,再用蒸馏水洗涤琼脂三次,用95%的酒精洗涤琼脂一次,用95%酒精浸泡琼脂过夜,滤去酒精,再用水洗,最后把洗过的琼脂在纱布上展成薄层晾干。处理过程约需10 d。
(2) 把琼脂放在玻璃缸内,用流水洗涤、并浸泡6~7d,用奈氏试剂检查无铵离子存在时,再用纱布包起来,将水滤干,最后展成薄层晾干备用。
(三)溶液
1. 氨基酸混合液或无维生素酪素水解物
配制无机培养基时,添加氨基酸的浓度见附录。
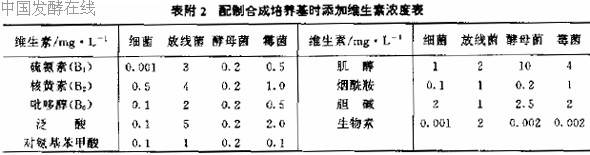
2. 水溶性维生素混合液
配制无机培养基时,添加维生素的浓度见附录。
3. 碱基混合液或核酸(RNA)水解液
配制无机培养基时,添加碱基的浓度见附录。RNA 水解液制作方法见附录。
4. 部分氨基酸组合液
另取20 种氨基酸按表1 组合成9 组氨基酸混合液。1~5 组每组含4 种氨基酸,6~9 组每组含5 种氨基酸,添加至基本培养基后,使每种氨基酸同时在两组中出现,供营养缺陷型标记确认用。
表 1 氨基酸不同组合表

5. 青霉素溶液
10 000 u/mL。
6. 其他溶液
磷酸缓冲液(pH 6.0,0.2 mol/L)、生理盐水、硫代硫酸钠溶液(0.5 mol/L)、亚硝基胍溶液(0.5mg/mL)。
(四) 仪器
台式离心机、旋涡混合器、恒温培养箱、电炉等。
(五) 其他物品
无菌移液管、无菌试管、无菌离心管、无菌锥形瓶、无菌培养皿、无菌玻璃涂棒、无菌牙签或插有大头针的无菌软木塞、稀释分离、平皿菌落计数所需的无菌生理盐水和无菌器皿等。
四、实验内容
(一) 诱变处理
1. 前培养
取新活化的棒杆菌T6-13 斜面菌种—环,接入盛有20 mL 完全培养基的250 mL 锥形瓶中,30℃振荡培养14~16 h,再取1mL 培养液转接于另一盛有20 mL 完全培养基的250 mL 锥形瓶中,30℃振荡培养4~6h,使细胞处于对数生长期。
2. 菌悬液制备
取10 mL 培养液于无菌离心管中,3500 r/min 离心10 min,弃上清液,打匀管底菌团,加入5mL 0.2mol/L pH 6.0 磷酸缓冲液,摇匀后倒入盛有45 mL 0.2mol/L pH 6.0 磷酸缓冲液并带玻璃珠的100 mL 锥形瓶中,振荡10 min,调整细胞浓度为5×108 个/mL,用完全培养基平板菌落计数法测定总菌数。
3. 诱变处理
(1) 称取0.5 mg NTG 于无菌离心管中,再加0.05mL 甲酰胺助溶,然后加入0.2 mol/LpH 6.0 磷酸缓冲液1mL,使完全溶解,用黑纸包好在30℃水浴中保温(临用时配制)。
NTG 是一种超诱变剂,需小心操作。称量药品时,戴好塑料手套和口罩,称量纸用完后立即烧毁;取样需用橡皮头的移液管,绝不能直接用嘴吸,接触沾染有NTG 的称液管、离心管、锥形瓶等玻璃器皿,需浸泡于0. 5 mol/L 硫代硫酸钠溶液中,置通风处过夜,然后再用水充分冲洗;溶液外溢时,用沾浸硫代硫酸钠溶液抹布擦洗;诱变处理后含NTG 的磷酸缓冲液及稀释液,立即倒入浓NaOH 溶液中,若手接触NTG,应立即用水冲洗。NTG 在可见光下会放出NO,使溶液颜色由土黄色变为黄绿色,故应放在棕色瓶中保存。
(2) 取4 mL 细胞悬浮液(5×108 个/mL 左右)加入上述离心管中,充分混匀,立即置30℃水浴振荡处理30 min(NTG 处理终浓度为100 ug/mL)后,离心收集菌体,将含NTG 的上清液倒入浓NaoH 溶液中弃去,用无菌水洗涤菌体3 次,以大量稀释法终止NTG 的诱变作用。最后向离心管中加5 mL 无菌生理盐水,摇匀后从中取出0.5 mL NTG 处理后的菌悬液,用4.5 mL 生理盐水稀释至10-3 稀释度。用倾注分离法在完全培养基平板上进行存活菌计数,每个稀释度做三个平皿,计算杀菌率。
4. 中间培养
将1 mL 诱变处理洗涤过的菌液,加入装有20 mL 完全培养基的250 ml 锥形瓶中,30℃振荡培养过夜(时间不宜太长,否则同一种突变株增殖过多)。
(二) 淘汰野生型(青霉素法)
1. 饥饿培养
取10 mL 中间培养液,3500 r/min 离心10 min,弃上清液,用无菌生理盐水洗涤菌体3 次,加到无氮源的基本培养基中,30℃振荡培养4~6 h。
2. 加青霉素
将上述经饥饿培养的菌液,3500 r/min 离心10 min,加到二倍氮源20 mL 基本培养基中,30℃振荡培养3~4 h,待野生型细胞刚进入对数生长期,对于G+菌加入青霉素的终浓度一般为50~100 u/mL,对于G-加入青霉素的终浓度为500 u/mL(青霉素母液过滤除菌后加入)。若在加青霉索同时,加入无菌的20%蔗糖和0.2% MgSO4(高渗透压培养液可防止野生型菌株因青霉素处理细胞壁裂解后原生质体涨破而提供营养缺陷型突变株营养物质),再继续培养5~6 h,达到淘汰野生型、浓缩缺陷型目的。
3. 制备悬液
取10 mL 上述菌液,3500 r/min 离心10 min。弃上清液,菌体用生理盐水洗涤一次,再加10 mL 生理盐水制备菌悬液。
用NTG 作诱变剂,突变率大,进行营养缺陷型突变株筛选时,可以不经中间培养和淘汰野生型步骤。诱变处理后经生理盐水洗涤和稀释的菌悬液,可直接进行营养缺陷型捡出。
(三) 营养缺陷型检出
可通过影印培养法和逐个检出法检出缺陷型。本次实验用逐个检出法检测。
1. 涂布菌悬液
各取0.1 mL 菌悬液,涂布于完全培养基和补充培养基平板上,各涂布10 个平皿,30℃培养36~48h。在补充培养基上生长的大菌落为野生型,小菌落为缺陷型,挑出小菌落直接进行营养缺陷型鉴定。完全培养基平板上长出的菌落再用逐个检出法检出缺陷型。
2. 制备平板
制备完全培养基平板和基本培养基平板,在平板底面可沾上一张划有36 个方格的硬纸片(如图1所示)。
3. 接种
用灭菌牙签或灭菌大头针从完全培养基平板或补充培养基平板上逐个挑取菌落或小菌落,对应点接种在基本培养基平板和完全培养基平板上。注意应先点接种基本培养基平板,后点接种完全培养基平板,接种量应少些。30℃培养48 h,在完全培养基平板上生长,而在基本培养基平板的对应位置不长的菌落,可能是营养缺陷型菌株(图 2)。将其接种于完全培养基斜面,30℃培养24 h,作为营养缺陷型鉴定用菌株。
如用影印法检出缺陷型时,完全培养基平板上的菌落,最好控制在30~60 个/皿,用影印法分别接种于完全培养基平板和基本培养基平板上。
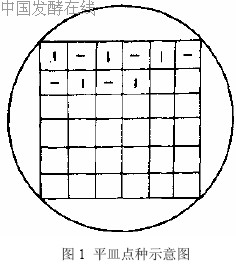
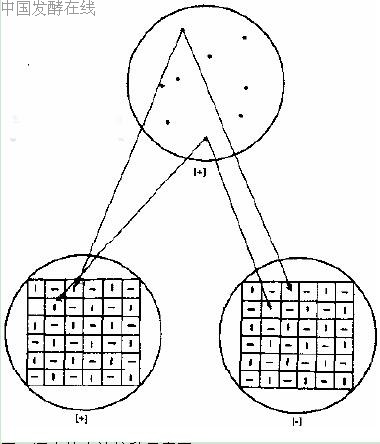
图2 逐个检出法接种示意图
[+]完全培养基; [-]基本培养基
琼脂表面潮湿,会使菌落扩散,即便倒置平皿培养,也会影响分离结果。注意倾注法制平板时,琼脂温度控制在45℃左右,最好提前1d 制作平板,让水分蒸发或30℃烘干过夜,或培养时用无菌粗陶瓷培养皿盖取代正常玻璃皿盖,也可在玻璃皿盖内层放浸有甘油的滤纸,吸取皿中蒸发的水分,以达防止菌落扩散的目的。
(四) 营养缺陷缺陷型菌株鉴定
1. 营养缺陷型生长谱法鉴定
(1) 将可能是营养缺陷型的菌株,接种于盛有5 mL 完全培养液的离心管中,30℃振荡培养14~16 h。
(2) 将菌悬液3500 r/min 离心10 min,弃去上清液,打匀管底菌团,用无菌生理盐水洗涤菌体3次,最后加5 mL 生理盐水制备菌悬液。
(3) 吸取1 mL 菌悬液,加入无菌培养皿中,倾注约15 mL 融化并冷却至45~50℃的基本琼脂培养基,摇匀待凝,共四皿。
(4) 在培养皿底部划分三个区域,做好标记。在每个区平板表面分别沾上沾有混合氨基酸(或酪素水解液)、混合核酸碱基(或RNA 水解液)、混合维生素溶液、酵母浸出溶液的滤纸片,30℃培养24 h,经培养后若某一类营养物质周围有生长圈,即表明为该类营养物质的营养缺陷型菌株(图 3)。有的菌株是双重营养缺陷型,可在两类营养物质扩散图交叉处看到生长区。
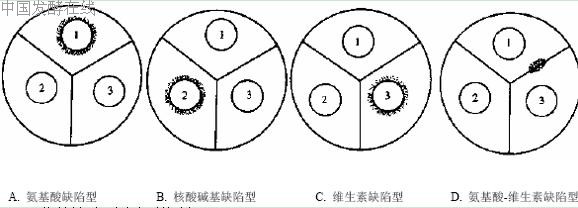
图 3 营养缺陷型生长谱测定
A. 氨基酸混合液;B. 核酸碱基混合液;C. 维生素混合液;D. 混合氨基酸及维生素溶液
2. 营养缺陷型突变株遗传标记的确定
所选出的营养缺陷型可能是氨基酸缺陷型、核酸碱基缺陷型、维生素缺陷型或双重营养缺陷型。氨基酸缺陷型较为常见,可将待测细菌培养至对数期,离心收集菌体,生理盐水洗涤3 次,制成菌悬液后划线接种到9 组含氨基酸的基本培养基平皿上(见表 1),若在某纵横两组的平板上发现菌生长,根据表1 即可查出是那种氨基酸营养缺陷型。如在第2 组和第8 组平板上长菌,即为赖氨酸营养缺陷型。也可在基本培养基上只加一种氨基酸的平板或基本培养基中只缺一种或几种氨基酸并组合有其他氨基酸的平板,通过划线接种而找出缺陷型。若是核酸碱基或维生素缺陷型,可依上法分别放置浸沾一种营养成分的滤纸片于混菌基本培养基平板上,从平板上生长谱测定鉴定营养缺陷型的类型。
五、实验报告内容
(一) 记录并计算NTG 处理后的杀菌率。
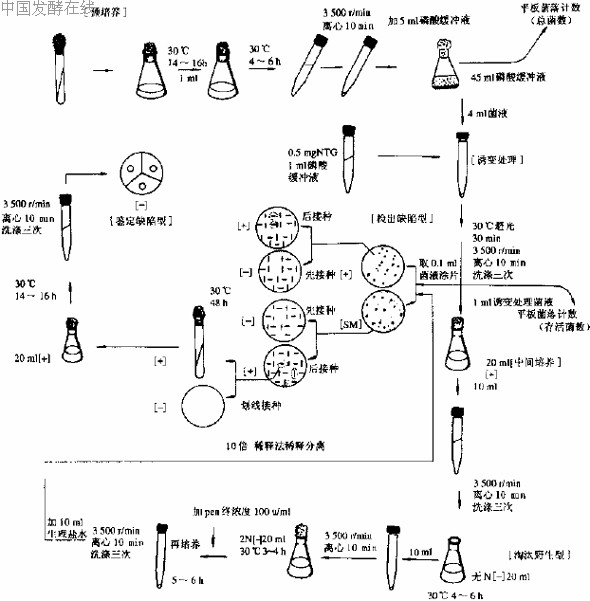
图 4 营养缺陷型筛选过程示意图
[+] 完全培养基;[-] 基本培养基;无N[-] 无N 基本培养基;2N[-] 二倍氮源基本培养基
图2 NTG 处理后的杀菌率
七 附录
筛选氨基酸营养缺陷试验用培养基
1. 细菌完全培养基
葡萄糖 0.5 g
牛肉膏 0.3 g
酵母膏 0.3 g
蛋白胨 1 g
MgSO4·7H2O 0.2 g
蒸馏水 100 mL
pH 7.2
100 Pa 灭菌20min。
2. 细菌基本培养基
葡萄糖 0.5 g
(NH4)2SO4 0.2 g
柠檬酸钠 0.1 g
MgSO4·7H2O 0.02 g
K2HPO4 0.4 g
KH2PO4 0.6 g
重蒸水 100 mL
pH 7.2
100 Pa 灭菌20 min。
配固体培养基时需加2%洗涤处理过的琼脂,全部药品需用分析纯,使用的器皿需用蒸馏水或重蒸
水冲洗2~3 次。
3. 无氮基本培养基
在基本培养基中不加(NH4)2SO4 和琼脂。
4. 二倍氮源基本培养基
在基本培养基中,加入2 倍(NH4)2SO4,不加琼脂。
5. 补充培养基(限制培养基)
(1) 基本培养基加一定浓度完全培养基在液体基本培养基中,加入0.1%~0.5%的完全培养基及2%琼脂。
(2) 基本培养基加混合氨基酸溶液
在配制基本培养基时,将20 种氨基酸分别依次缺少一种而使其中含有其他19 种氨基酸然后接入待测菌,在哪种培养基上不长菌,就是缺哪种氨基酸的营养缺陷型。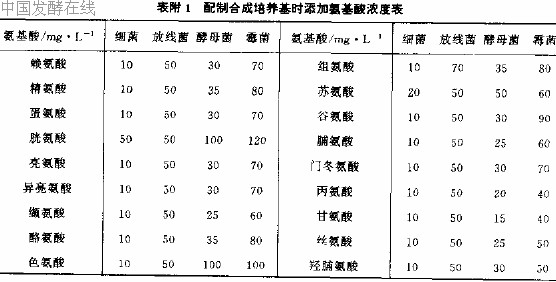
注:若用d1 型氨基酸,量应加倍,若用酪素水解物作混合氢基酸,应补加胱氨酸(50 mg/mL)和色氨酸
(3) 基本培养基加混合维生素溶液
在配制基本培养基时,将9 种维生素分别依次缺少一种而使其中含有其他8 种维生素,
然后接入待测定菌,在哪种培养基上不长菌,就是缺哪种维生素的营养缺陷型
(4)基本培养基加混合核酸碱基溶液
配制基本培养基时,将7 种核酸碱基分别依次缺少一种而使其中含有其他6 种核酸碱基然后接入
待测定菌,在哪种培养基上不长菌,就是缺哪种核酸碱基的营养缺陷型。
表附3 配制合成培养基时添加核酸碱基浓度表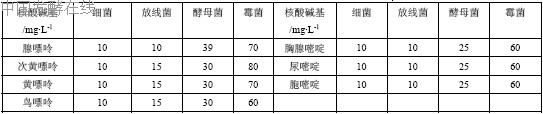
注:RNA 水解液可代替核酸碱基溶液,可用于混合核酸碱基溶液
上述氨基酸、维生素和核酸碱基均应磨细后分装成小管,放干燥器中避光保存,临用时配成溶液,过滤除菌。
RNA 水解液的配制:
取2 g RNA,加入15 mL 1 mol/L NaOH;另取2 g RNA,加入15 mL 1 mol/L HCl,分别于100℃水浴加热水解20 min,将两种溶液混合,调pH 为6.0,过滤后调整体积为40 mL。可用RNA 水解液作为混合核酸碱基。
如用水解干酪素作为混合氨基酸,则需添加胱氨酸50 mg/L 和色氨酸10 mg/L。
试剂配制
(一) 0.5 mol/L 硫代硫酸钠溶液(浸泡沾染过NTG 的破璃器皿)
称取124 g 硫代硫酸钠(Na2S2O3·5H2O),溶于蒸馏水中,定容至1000 mL,贮于棕色瓶中,保存备用。
(二) 0.2 mol/L 磷酸缓冲液(pH 5.8、pH 6.0、pH 7.4)
Na2HPO4·2H2O 相对分子质量为178.05,0.2 mol/L 溶液含35.61 g/L,称取35.61 g Na2HPO4·2H2O ,溶解于蒸馏水中,定容至1000 mL。
NaH2PO4·H2O 相对分子质量为138.01,0.2 mol/L 溶液含27.6 g/L,称取27.6 g NaH2PO4·H2O ,溶解于蒸馏水中,定容至1000 mL。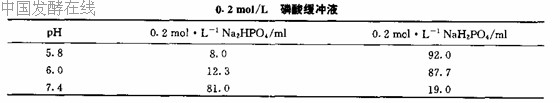
上一篇:人工神经网络技术在微生物工程方面的应用
下一篇:营养缺陷型突变株的筛选
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

