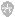黄孢原毛平革菌产木素过氧化酶的研究
2007-12-18 22:04:55 来源:本站原创 评论:0 点击:
摘要:本实验先采用正交设计法对黄孢原毛平革菌产木素过氧化物酶的培养条件进行优化,再通过放大实验对最佳培养条件进行验证,最终得出结果:最佳培养条件主要参数为:pH4.5、葡萄糖:10g/L、酒石酸铵:0.2g/L、吐温-80:0.2g/L。
关键词:黄孢原毛平革菌,木素过氧化酶,藜芦醇
黄孢原毛平革菌,(Phanerochaete chrysosporium,简称P. Chrysosporium)是一种丝状真菌,区别于单细胞微生物。菌对底物进行降解时,其次生代谢活动对反应环境的要求较为苛刻,需要一定的营养组分和严格的偏酸环境(pH约4.5左右)。其对底物(染料)的降解主要是依靠其次生代谢产物——胞外木素分解酶系。胞外木素分解酶系的发现是利用黄孢原毛平革菌降解木质素研究的重大进展。该酶系是一组同功酶,由两类酶构成:木素过氧化物酶(Lignin peroxidases,简称Lip)和锰过氧化物酶(Mn dependent peroxidases,简称Mnp)。kirkTK[1]小组于1983年首次从黄孢原毛平革菌培养基中发现木素过氧化物酶,并发现该酶与赖锰酶(Mnp)、漆酶(Laccase)构成木素降解酶体系,该酶系有一个很重要的特点,就是它对底物的氧化是高度非特异性的,广泛研究表明,该菌可以降解多种染料,包括偶氮类、三苯甲烷类、杂环类、聚合染料等,在染料废水处理方面具有广泛的应用前景[2],目前该菌已成为这类研究的模型菌种。在国外,利用黄孢原毛平革菌降解各种结构各异的污染有机物已经成为一个非常热门的研究方向,他们已在木素降解酶系的生产、酶系的性质、酶系的分子生物学研究和利用酶系降解有机污染物方面作了大量的工作。而我们国内的研究却起步比较晚,开始于九十年代初,主要在木素过氧化物酶的生产条件和木素酶漂白纸浆废水方面进行了一些探索。[3]
Pasti[4] 已完成了 P. Chrysosporium 产生的 Lip对 22 种偶氮染料的氧化速率的测定。而且在整个合成阶段Lip的合成量要比Mnp大得多,再加上Lip能降解木质素的模型物,因此Lip在木质素的降解中起着主导作用,成为后来的主要研究酶。[5] 本文主要通过对黄孢原毛平革菌培养条件进行优化--正交设计法对培养基组分进行优化,再通过放大实验对最佳培养基条件进行验证比较。从而最终确定对黄孢原毛平革菌产木素过氧化酶最有利的培养基方案。
1 材料和方法
1.1 材料
斜面培养基:马铃薯琼脂培养基(PDA培养基):马铃薯煮汁1000mL,蔗糖20g,琼脂20g,pH4.8~6.0。
基本培养基:葡萄糖,酒石酸铵,吐温-80,以上成分的量按正交表设计添加。醋酸缓冲液10mmoL/L(pH4.5),KH2PO4 2g/L,VB1 1mg/L,0.5M藜芦醇溶液1.0mL/100mL,微量元素混合液70mL/L,注意此时分不同pH值(4.0、4.5、6.0)。
微量元素混合液(L-1):氨基乙酸:0.5g,MgSO4·7H2 O:3g,NaCl:11g,FeSO4·7H2O:0.1g,CoSO4:0.1g,CaCl2·2H2O:0.1g,ZnSO4·7H2O:0.19g,CuSO4·5H2O:0.01g,AlK(SO4)2·12H2O:0.01g,H2BO3 :0.01g,Na2Mo·2H2O:0.01g,MnSO4·H2O:0.01g。
0.1%标准葡萄糖溶液:准确称取
斐林试剂
1.2 方法
1mL反应液中含0.2mL藜芦醇溶液、0.4ml酒石酸缓冲液(250mmoL/L,pH 3.0)、0.4mL培养液或稀释液、20μLH2O2溶液(20mmoL/L),于
2 结果与讨论
2.1 确定最佳培养时间 在静置和摇床培养条件下测定黄孢原毛平革菌5.776产木素过氧化物酶(Lip)活力随培养时间的变化,结果如图1,Lip活力在第6d出现峰值,达到69.1U/L。Lip属于次级代谢产物,与菌体生长不同步[7],且Lip的合成与菌体生长是非偶联的。由此确定第6d是研究培养条件改变对Lip活力影响最适时间。[8]
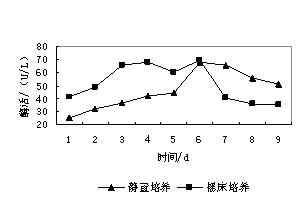
图1:对照酶活变化曲线
2.2 正交表的选择 选取pH、葡萄糖、酒石酸铵、吐温-80为考察因素,每个因素取3个水平,按正交表L9(34)来设计实验[9],正交表如下:
表1 正交试验因素水平的安排[10]
|
因素 水平 |
A pH |
B 葡萄糖(g/L) |
C 酒石酸铵(g/L) |
D 吐温-80(g/L) |
|
1 2 3 |
3.0 4.5 6.0 |
2.0 5.0 10.0 |
0.2 0.5 1.0 |
0.2 0.5 1.0 |
2.3 数据分析
从上述结果可以做出判断:在其它条件相同的情况下,培养基中碳源(葡萄糖)丰富时更有利于黄孢原毛平革菌产木素过氧化酶,相比其他,其酶活性高出2~3倍。同时,根据喻国策等[11]的研究也表明,木质素降解酶的产生受氮浓度条件影响,低氮浓度有利于酶的产生,高氮浓度则抑制酶的产生。
表2 正交试验结果分析表
|
因素 水平 |
A |
B |
C |
D |
Xi酶活力 (U/L) | |
|
1 2 3 4 5 6 7 8 9 |
1 2 3 1 2 3 1 2 3 |
1 1 1 2 2 2 3 3 3 |
2 1 3 1 3 2 3 2 1 |
3 1 2 2 3 1 1 2 3 |
26.1 57.7 31.8 18.7 24.0 22.7 91.9 78.1 81.0 | |
|
Lip 含 量 |
K1 K2 K3 S k1 k2 k3 R |
136.7 159.8 135.5 125.1 45.6 53.3 45.2 8.1 |
115.6 65.4 250.0 6106.8 38.5 21.8 83.7 61.9 |
157.4 126.9 147.7 161.9 52.5 42.3 49.2 10.2 |
172.3 128.6 131.1 401.5 57.4 42.9 43.7 14.5 |
总和432 ST = 6795.3 |
表3 Lip活力方差分析表
|
方差来源 |
平方和 |
自由度 |
均方 |
F值 |
显著性 |
|
A B C D |
125.06 5977.51 161.89 418.98 |
2 2 2 2 |
62.53 2988.76 80.95 204.49 |
| |
|
47.80 1.29 3.27 |
** 不显著 不显著 | ||||
F0.05(2,2)=19.0;F0.025(2,2)=39.0 [ 12 ]
2.4 确定最优培养基方案
从极差和方差分析中看出影响黄孢原毛平革菌产木素过氧化物歧化酶的因素的主次顺序为葡萄糖浓度(碳源)> 酒石酸铵浓度(氮源)> 吐温-80 > pH,其中酒石酸铵浓度和吐温-80浓度对木素过氧化物歧化酶活力的增加的影响不明显,葡萄糖浓度的影响则为很显著。而pH对酶活力影响很小(误差)。所以正交实验的最佳培养基条件为A2B3C1D1,即pH在4.5,葡萄糖(碳源)含量为10.0g/L,酒石酸胺(氮源)含量为0.2g/L,吐温-80含量为0.2g/L时为最优培养基方案。
利用最优方案对该实验进行放大试验,具体方案如下:
培养液体积:3L、pH4.5、葡萄糖:10g/L、酒石酸铵:0.2g/L、吐温-80:0.2g/L、醋酸缓冲液10mmoL/L(pH4.5),KH2PO4 2g/L,VB1 1mg/L,0.5M藜芦醇溶液(VA)10mL/L,微量元素混合液70mL/L、温度:37°C、接种量:1.0x109个孢子/L、转速:80r/min,培养时间为8d,测定酶活方法同上,同时,测定菌体干重、DO2值、pH变化以及残糖含量,结果如下:
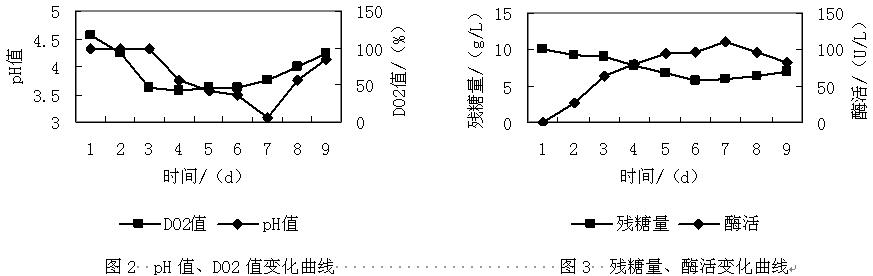
综合上述两图(图2和图3)可知,黄孢原毛平革菌生长的迟缓期很短,在曲线中基本上无法体现出来。不过对于一般生产周期较短的真菌而言,这是比较正常的。而菌体的对数生长期则较明显(1~3d),此过程中黄孢原毛平革菌以最大的速率生长和分裂,菌体数量呈对数增加,而且菌体内各成分也按照同样的比例有规律的增加,由于黄孢原毛平革菌是好氧微生物,所以在生长的同时大量的消耗氧气,导致DO2值明显下降。随着菌体的生长,也伴随着生长代谢产物的生成,对于黄孢原毛平革菌来说,主要的代谢产物是过氧化物酶和乙二醛氧化酶。随着营养物质的消耗,代谢产物积累和pH等环境的变化,逐步不宜黄孢原毛平革菌的生长,导致生长速率逐渐降低,从而进入稳定期,这个阶段也就是黄孢原毛平革菌产木素过氧化酶的最佳时间,即培养过程中的4~7d,此阶段木素过氧化酶的酶活性最高,具体出现在培养的第7d,酶活高达110U/L,比同时期摇床培养最高酶活(91.9U/L)高接近20U/L。随着氮源(酒石酸铵)的耗尽,菌体也开始死亡,自溶,从而造成pH和溶氧的回升。
3 结论
黄孢原毛平革菌产木素过氧化酶的最佳培养条件为:pH在4.5,葡萄糖(碳源)含量为10.0g/L,酒石酸胺(氮源)含量为0.2g/L,吐温-80含量为0.2g/L。
但在实验过程中我们也发现,在氮源耗尽时还有相当量的葡萄糖存在,约在6g/L左右,所以可考虑适当降低培养基中葡萄糖的含量,以减少资源浪费,增加效益。
作者简介:郑锐东(1982 - ),男,学士,揭阳职业技术学院生物工程系助教,主要从事微生物工程的相关工作。
参考文献:
[1]丁佐龙,邢邦启.木素过氧化物酶合成的部分影响因素[J].合肥工业大学学报(自然科学版),1998,6(21):1~2.
[2]章燕芳,李华钟,华兆哲等.黄孢原毛平革菌合成的木质素过氧化物酶、锰过氧化物酶及其菌球在染料脱色过程中的作用[J]. 过程工程学报,2002,3(2):246.
[3]梁园园,张朝晖,周哓云.黄孢原毛平革菌木素降解酶系的研究进展[J].工业微生物, 2003,4(33):42~43.
[4]Pasti MB, PaszczynskiA,GoszczynskiS,etal.Influence of Aromatic Substitution Patterns on Azo Dye Degradability by Stretomyces sp.and Phanerochaete chrysosporium [J]. Appl. Environ. Microbiol., 1992, 58(11):3605~3613.
[5]张朝晖,夏黎明,林建平等.黄孢原毛平革菌培养合成木素过氧化物酶研究[J]。 浙江大学学报(自然科学版),1999,2(33):132~133.
[6]华南理工大学等.工业发酵分析[M].北京:中国轻工业出版社, 2003.16~17.
[7]刘稳,李杨,高培基等.过氧化物酶研究进展[J].纤维素科学与技术,2000,8(2):50~64.
[8]杨晓宽,杜连祥,路福平等.白腐菌产锰过氧化物酶培养基的优化.生物技术, 2004,3(14):49.
[9]武继玉.应用概率统计[M].北京:航空工业出版社,1994.254~261.
[10]刘心平.多水平正交试验用表的逻辑设计[J].摇测摇控,1995,4(17):38~48.
[11]喻国策,文湘华,李东锋等.黄孢原毛平革菌在多种氨氮浓度下木质素降解酶的产生[J].环境科学学报,2003,6(23):804.
[12]肖攸南等.概率论与数理统计[M].北京:北京大学出版社,2002.附表5.
上一篇:生物柴油专用脂肪酶的开发及其应用研究
下一篇:蔗糖工业用复合酶制剂研究及生产应用
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)