低温胁迫下烟草海藻糖与海藻糖酶的动态关系研究
2010-09-21 15:58:19 来源:本站原创 评论:0 点击:
关键词 海藻糖 海藻糖酶 烟草
Studies on the dynamic relation between trehalose and
trehalase during cold-stress in tobacco
Yi Ke1,2, Chen Gang2, Wang Yong1, Gong Baoguo1, Zhou Jiheng3, Zhou Qingming3
(1. Technological center, CDCF Changde 411300
2. Lab of Biochemistry and Ferment Engineering, HNAU Changsha 410128
3. Technological Center of tobacco engineering, HNAU Changsha 410128)
Abstract: The changes of several physiological and biochemical indexes of tobacco K326 during cold-stress, which has been treated by cold-exercise,trehalose and jinggangmycin A, were assayed in this study. The results suggested: (1)Three treatments all resulted that the contents of trehalose in tobacco increased and the activity of trehalase decreased, which proved that trehalose may be a product result of stress. (2)The contents of soluble protein took changes after different treatments, meanwhile, the results of SDS-PAGE showed that stress-relative protein may be induced or enhanced expression.
Key Words: trehalose; trehalase; tobacco
海藻糖是由两个葡萄糖分子通过半缩醛羟基结合而成的一种非还原性双糖,广泛存在于低等植物、藻类、细菌、昆虫及无脊椎动物中。作为一种渗透调节物质,海藻糖被证实具有维持膜完整性和蛋白质稳定性的能力,保护生物组织和生命物质不受破坏[1]。存在于细胞浆内的海藻糖含量依外界环境的变化而不同,它被认为是一种典型的应激代谢物[2]。大量研究指出,某些物种对外界恶劣环境,如脱水、干旱、高温、冷冻、高渗透压及有毒试剂等所表现出来的抗逆耐受力和它们体内存在的海藻糖有直接关系。深入研究表明,在上述极端严酷的条件下,海藻糖可以对生物膜、蛋白质和核酸等生物大分子发挥保护作用,从而使富含该化合物的生命体对外界恶劣环境表现出独特的生物学特性[1,3]。
先前,人们认为海藻糖主要存在于共生植物中。但是,最近有人发现高等植物中也潜在地具有合成海藻糖的能力,因为6-磷酸-海藻糖合成酶与6-磷酸海藻糖-磷酸合成酶的同源性在拟南芥中已经被确定[4]。然而,海藻糖积聚与缺乏取决于海藻糖酶的活性,因此必须了解海藻糖酶在海藻糖新陈代谢中的作用。海藻糖酶(trehalase)(EC.3.2.1.28)存在于各种生物中,其水解产物为葡萄糖。中性海藻糖酶基因目前已被克隆,在其肽链的N端区存在两个可能的磷酸化位点,从而参与调节细胞响应不同环境下的海藻糖浓度[5]。植物中海藻糖酶活性的降低可以提高植物的抗逆性。有研究报道了烟草和马铃薯中海藻糖的生物合成,通过分别引入Escherichia coli.中的otsA和otsB基因,可以相应地编码海藻糖-6-磷酸合酶和海藻糖-6-磷酸磷酸酶。在转基因烟草的叶子中,只能获得微量的海藻糖(0.11mg•g-1FW),然而在转基因马铃薯块茎中,却无法检测出海藻糖[6]。
根据前人的研究基础,本研究拟通过低温或诱导剂处理,来确证烟草体内这类应激物——海藻糖的存在性,并通过海藻糖及海藻糖酶两者之间的动态变化,为烟草非生物逆境抗性提供一定的思路。
材料与方法
1. 试验材料
烟草品种K326,由中南烟草实验站胡日生博士提供。
2. 试验方法
2.1 材料培养与处理
试验在湖南农业大学烟草工程技术中心人工气候室进行。选取长势一致的五叶一心期烟草幼苗,分为四组,每组20株,重复三次:①低温锻炼组。即将烟草幼苗先进行4 d低温锻炼,培养条件为10℃,光照时间12h/d,光量子通量密度(PFD)为30mol•m-2•s-1;②海藻糖处理组。,培养条件为昼27℃,其余同①;③井冈霉素A处理组。将20mg/L井冈霉素A连续处理幼苗3d,培养条件同②;④对照组。培养条件同②。3天恢复期后,连续4d进行低温胁迫处理,条件为昼6℃,其余同②。各处理组分别于处理前、处理期、恢复期、胁迫期取样测定有关指标。
2.2 海藻糖提取及含量测定
参照郭永霞的方法进行[7],有改动:剪取同一部位新鲜叶片,烘干固定,研磨成粉。称取1g样品,100℃水浴30min,12000rpm离心20min,上清浓缩至20mL,用无水乙醇溶解致其终浓度为80%。80℃水浴不断搅拌使乙醇充分挥发。采取酸碱水解法除去可溶性糖中的还原性糖,海藻糖的损失约为1%。
参照钟国华的方法进行[8],利用蒽酮比色建立海藻糖标准曲线。烟草中海藻糖的测定方法是:取待测样0.2mL,在630nm下测定光吸收值,并按标准曲线求海藻糖量。
2.3 烟草中海藻糖酶的提取及活性测定
参照Müller等的方法进行[9]。即以海藻糖为底物,将柠檬酸钠提取酶液在37℃下反应30min。沸水浴使酶失活,使用葡萄糖液体试剂盒测定葡萄糖含量。烟草海藻糖酶的活力单位定义为:单位时间(min)内海藻糖转换为葡萄糖的量(µg/mL)。
2.4 烟草蛋白质含量测定
采取Bradford法测定烟草蛋白质含量[10]。
2.5 可溶性蛋白质SDS-PAGE分析
电泳采用垂直板不连续聚丙烯酰胺凝胶电泳,凝胶厚度1.0mm,浓缩胶浓度为3%,分离胶浓度为10%,交联度为2.6%。
结果与分析
1. 低温胁迫期间烟草海藻糖与海藻糖酶活性的动态变化
采用蒽酮硫酸法,建立不同浓度梯度的海藻糖标准曲线,对所得OD值进行分析获得回归方程:A=1.3711C,其中R2=0.9998,r=0.9999。
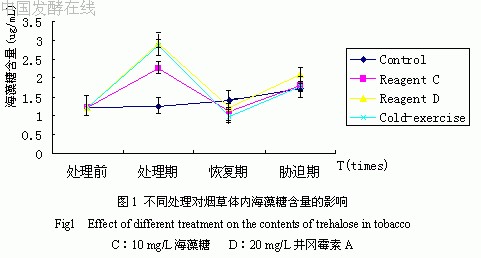
低温和不同药剂处理对烟草体内海藻糖含量的影响如图1所示。由图可见,各种处理均不同程度地提高了烟草体内的海藻糖含量,且井冈霉素A处理组>低温锻炼组>海藻糖处理组>对照组,此外,处理期和胁迫期的海藻糖含量分别较处理前和恢复期有所增高。这表明逆境或药剂可影响烟草使之体内的海藻糖含量增多,而一旦“警报”解除,海藻糖可能迅速降低。这种降低可能与海藻糖酶活性相关(图2)。
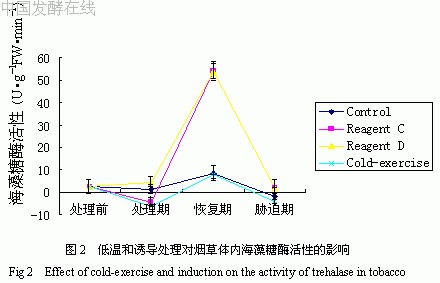
低温和诱导处理对烟草体内海藻糖酶活性的影响如图2所示。由图可见,在处理期与胁迫期,海藻糖酶活性低,烟草受逆境或药剂处理影响,体内分泌的海藻糖量增加。而各个处理的烟草海藻糖酶在恢复期的活性均迅速增加,其活性大小表现为冷处理组>药剂D处理组>药剂C处理组>对照组。这表明,在恢复期,由于逆境解除,海藻糖酶活性迅速升高,使得由于低温或诱导处理造成的高浓度海藻糖恢复至最低水平,这也证实了海藻糖很可能存在于处于应激状态的高等植物体内。
2.低温胁迫期间可溶性蛋白质含量的变化
测定蛋白质含量标准曲线的回归方程是A=0.5547C,其中R2=0.9956,r=0.9978。
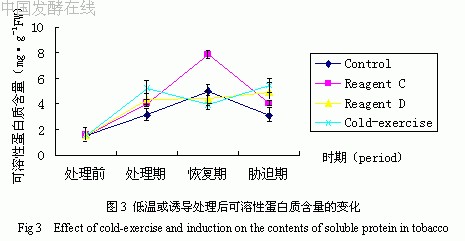
低温或诱导处理后可溶性蛋白质含量的变化如图3所示。由图可见,各处理均引起烟草体内蛋白质含量增加,其顺序为:冷处理组>药剂D处理组>药剂C处理组>对照组,这与海藻糖酶活性变化结果一致。这可能是应激环境造成植物体内蛋白质合成增加,引起一系列相关酶的合成来抵御逆境。
3.低温胁迫期间烟草可溶性蛋白质SDS-PAGE分析
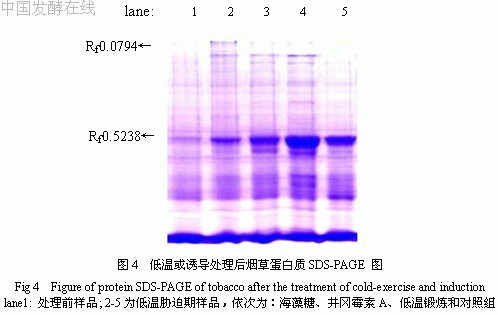
研究分析了低温或诱导处理后不同时期烟草可溶性蛋白质SDS-PAGE的变化,结果如图4所示。由图可见,在处理期形成了两条新增蛋白质谱带(Rf0.0794与Rf0.5238),其种类、性质及功能有待进一步研究。此外在胁迫期间,各处理组蛋白质表达明显增强。
讨 论
在自然界中寻找安全无毒性的抗逆保护剂是非生物逆境植保体系中最诱人的手段。海藻糖最引人注目的是其独特的生物学性质,即很多生物在极端条件下均能通过体内调节增加自身海藻糖的含量,稳定细胞膜和蛋白质的结构,以抵御外界逆境如冷冻、干燥、高渗压等对自身的伤害。海藻糖在细胞中的主要功能是一种典型的应激代谢物。但一直以来,人们普遍认为在大多数高等植物体内不存在海藻糖。然而拟南芥试验的成功[4]使人们开始考虑海藻糖在作物生产上的应用。基于此,为早日将海藻糖这种安全无毒有效的抗逆保护剂开发应用,本研究针对低温胁迫作了一些探索性研究,获得了如下结论:
⑴烟草在非生物逆境胁迫下,烟草体内的海藻糖含量变化与海藻糖酶活性的变化是呈一种此消彼涨的关系,海藻糖酶的活性低,海藻糖的含量迅速增多,起着保护生物组织和生命物质不受破坏的作用,因而达到抗逆的效果。同时,这也证明了海藻糖确实是一种典型的应激代谢物。
⑵井冈霉素A与有效霉素的结构与功能有类似之处,对机体内海藻糖酶活性有较强的抑制作用。这也提示我们在自然界中还可能通过寻找海藻糖酶抑制剂来提高海藻糖含量。
⑶烟草在非生物逆境胁迫下,体内蛋白质含量的变化也发生一定的变化,这种现象这可能是应激环境造成植物体内蛋白质合成增加,引起一系列抗逆相关酶的合成。烟草在处理期和胁迫期均有新增的谱带,进一步证实了应激环境可能造成植物体内抗逆蛋白的诱导形成。不过,逆境相关蛋白的结构与功能,还有待进一步的研究。
参考文献
[1] Crowe J.H., Hoekstra F.A., Crowe L.M. Anhydrobiosis. Annu. Rev. Physiol. 1992,54:579-599
[2] Denis Rontein, Gilles Basset, Andrew D. Hanson. Metabolic engineering of osmoprotectant accumulation in plants. Metabolic Engineering, 2002, 2:49-56
[3] 聂凌鸿,宁正祥. 海藻糖的生物保护作用. 生命的化学,2001,21(3):206-209
Roger A.Aeschbacher*,Joachim Muller,Thomas Boller,et al. Purification of the Trehalase GMTRE1 from Soybean Nodules and Cloning lts cDNA .GMTRE1 is Expressed at a low level in Multiple Tissues.Plant Physiology,1999,199:489-495
[4] Oscar J.M.Goddijin and Kees van Dun. Trehalose metabolism in plants. Trends in Plant Science, 1999, 4(8):315-319
[5] J. Müller, A.Wiemken, R. Aeschbacher. Trehalose metabolism in sugar sensing and plant development. Plant Science, 1999,147:37-47
[6] Oscar J.M.Goddijin,Theo C.Verwoerd,Eline Voogd,et al.Inhibition of Trehalase Activity Enhances Trehalose Accumulation in Transgenic Plants.Plant Physiol,1997,113:181-190
[7] 郭永霞. 井冈霉素A诱导水稻防御纹枯病的生理生化机理研究.河南农业大学硕士论文,2002
[8] 钟国华. 闹羊花素-Ⅲ对菜青虫海藻糖含量及海藻糖酶活性的影响. 华中农业大学学报. 2000, 19(2):119-123
[9] Muller, J. et al. Effects of validamycin A, a potent trehalase inhibitor, and phytohormones on trehalose metablism in roots and root nodules of soybean and cowpea. Planta (Heidelberg). 1995. 197(2):362-368
[10] Bradford M.H. A rapid and sensitive method for the guantitation of microgram guantities of protein utilizing the principle of protein-dye binding. Annu. Biochem. 1976, 72: 248-254
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

