| 活体动物体内光学成像(Optical in vivo Imaging)主要采用生物发光(bioluminescence)与荧光(fluorescence)两种技术。生物发光是用荧光素酶(Luciferase)基因标记细胞或DNA,而荧光技术则采用荧光报告基团(GFP、RFP, Cyt及dyes等)进行标记。利用一套非常灵敏的光学检测仪器,让研究人员能够直接监控活体生物体内的细胞活动和基因行为。通过这个系统,可以观测活体动物体内肿瘤的生长及转移、感染性疾病发展过程、特定基因的表达等生物学过程。传统的动物实验方法需要在不同的时间点宰杀实验动物以获得数据, 得到多个时间点的实验结果。相比之下,可见光体内成像通过对同一组实验对象在不同时间点进行记录,跟踪同一观察目标(标记细胞及基因)的移动及变化,所得的数据更加真实可信。另外, 这一技术对肿瘤微小转移灶的检测灵敏度极高,不涉及放射性物质和方法, 非常安全。 因其操作极其简单、所得结果直观、灵敏度高等特点, 在刚刚发展起来的几年时间内,已广泛应用于生命科学、医学研究及药物开发等方面。 | 1. 标记原理
哺乳动物生物发光,是将Fluc基因整合到细胞染色体DNA上以表达荧光素酶,当外源(腹腔或静脉注射)给予其底物荧光素(luciferin),即可在几分钟内产生发光现象。这种酶在ATP及氧气的存在条件下,催化荧光素的氧化反应才可以发光,因此只有在活细胞内才会产生发光现象,并且光的强度与标记细胞的数目线性相关。对于细菌,lux操纵子由编码荧光素酶的基因和编码荧光素酶底物合成酶的基因组成,带有这种操纵子的细菌会持续发光,不需要外源性底物。
基因、细胞和活体动物都可被荧光素酶基因标记。标记细胞的方法基本上是通过分子生物学克隆技术, 将荧光素酶的基因插到预期观察的细胞的染色体内,通过单克隆细胞技术的筛选, 培养出能稳定表达荧光素酶的细胞株。将标记好的细胞注入小鼠体内后, 观测前需要注射荧光素酶的底物—荧光素,为约280道尔顿的小分子。荧光素脂溶性非常好, 很容易透过血脑屏障。注射一次荧光素能保持小鼠体内荧光素酶标记的细胞发光30-45分钟。每次荧光素酶催化反应只产生一个光子,这是肉眼无法观察到的,应用一个高度灵敏的 VERSARRAY 1300B制冷CCD相机及特别设计的成像暗箱和成像软件,可观测并记录到这些光子。
2. 光学原理
光在哺乳动物组织内传播时会被散射和吸收,光子遇到细胞膜和细胞质时会发生折射现象,而且不同类型的细胞和组织吸收光子的特性并不一样。在偏红光区域, 大量的光可以穿过组织和皮肤而被检测到。利用灵敏的活体成像系统最少可以看到皮下的500个细胞,当然,由于发光源在老鼠体内深度的不同可看到的最少细胞数是不同的。在相同的深度情况下, 检测到的发光强度和细胞的数量具有非常好的线性关系。可见光体内成像技术的基本原理在于光可以穿透实验动物的组织并且可由仪器量化检测到的光强度,同时反映出细胞的数量。
3. 实验过程
通过分子生物学克隆技术, 应用单克隆细胞技术的筛选,将荧光素酶的基因稳定整合到预期观察的细胞的染色体内,培养出能稳定表达荧光素酶蛋白的细胞株。
典型的成像过程是:小鼠经过麻醉系统被麻醉后放入成像暗箱平台,软件控制平台的升降到一个合适的视野,自动开启照明灯拍摄第一次背景图。下一步,自动关闭照明灯, 在没有外界光源的条件下拍摄由小鼠体内发出的光,即为生物发光成像。 与第一次的背景图叠加后可以清楚的显示动物体内光源的位置,完成成像操作。之后,软件完成图像分析过程。使用者可以方便的选取感兴趣的区域进行测量和数据处理及保存工作。当选定需要测量的区域后,软件可以计算出此区域发出的光子数,获得实验数据。软件的数据处理和保存功能非常强大,可以加快实验速度,方便大批量的实验。
4.荧光成像功能
荧光发光是通过激发光激发荧光基团到达高能量状态,而后产生发射光。常用的有绿色荧光蛋白(GFP)、红色荧光蛋白DsRed 及其它荧光报告基团,标记方法与体外荧光成像相似。荧光成像具有费用低廉和操作简单等优点。 同生物发光在动物体内的穿透性相似,红光的穿透性在体内比蓝绿光的穿透性要好得多,近红外荧光为观测生理指标的最佳选择。
虽然荧光信号远远强于生物发光,但非特异性荧光产生的背景噪音使其信噪比远远低于生物发光。虽然许多公司采用不同的技术分离背景光,但是受到荧光特性的限制,很难完全消除背景噪音。这些背景噪音造成荧光成像的灵敏度较低。目前大部分高水平的文章还是应用生物发光的方法来研究活体动物体内成像。 但是,荧光成像有其方便,便宜,直观,标记靶点多样和易于被大多数研究人员接受的优点,在一些植物分子生物学研究和观察小分子体内代谢方面也得到应用。对于不同的研究,可根据两者的特点以及实验要求,选择合适的方法。最近许多文献报道的实验中,利用绿色荧光蛋白和荧光素酶对细胞或动物进行双重标记,用成熟的荧光成像技术进行体外检测,进行分子生物学和细胞生物学研究;然后利用生物发光技术进行动物体内检测, 进行活体动物体内研究。 | 通过活体动物体内成像系统,可以观测到疾病或癌症的发展进程以及药物治疗所产生的反应,并可用于病毒学研究、构建转基因动物模型、siRNA研究、干细胞研究、蛋白质相互作用研究以及细胞体外检测等领域。具体应用如下:
1. 标记细胞
(1) 癌症与抗癌药物研究
直接快速地测量各种癌症模型中肿瘤的生长和转移,并可对癌症治疗中癌细胞的变化进行实时观测和评估。活体生物发光成像能够无创伤地定量检测小鼠整体的原位瘤、转移瘤及自发瘤。活体成像技术提高了检测的灵敏度,即使微小的转移灶也能被检测到(可以检测到体内102个细胞的微转移)。
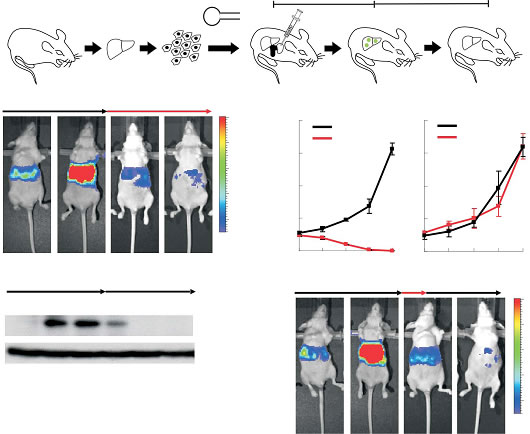
Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas
Wen Xue1*, Lars Zender1*, Cornelius Miething1, Ross A. Dickins1,2, Eva Hernando3, Valery Krizhanovsky1,
Carlos Cordon-Cardo3 & Scott W. Lowe1,2
Although cancer arises from a combination of mutations in oncogenes and tumour suppressor genes, the extent to which tumour suppressor gene loss is required for maintaining established tumours is poorly understood. p53 is an important tumour suppressor that acts to restrict proliferation in response to DNA damage or deregulation of mitogenic oncogenes, by leading to the induction of various cell cycle checkpoints, apoptosis or cellular senescence1,2. Consequently, p53 mutations increase cell proliferation and survival, and in some settings promote genomic instability and resistance to certain chemotherapies3. To determine the consequences of reactivating the p53 pathway in tumours, we used RNA interference (RNAi) to conditionally regulate endogenous p53 expression in a mosaic mouse model of liver carcinoma4,5. We show that even brief reactivation of endogenous p53 in p53-deficient tumours can produce complete tumour
regressions. The primary response to p53 was not apoptosis, but instead involved the induction of a cellular senescence program that was associated with differentiation and the upregulation of inflammatory cytokines. This program, although producing only cell cycle arrest in vitro, also triggered an innate immune response that targeted the tumour cells in vivo, thereby contributing to tumour clearance. Our study indicates that p53 loss can be required for the maintenance of aggressive carcinomas, and illustrates how the cellular senescence program can act together with the innate immune system to potently limit tumour growth.。
(2) 免疫学与干细胞研究
将荧光素酶标记的造血干细胞移植入脾及骨髓,可用于实时观测活体动物体内干细胞造血过程的早期事件及动力学变化。有研究表明,应用带有生物发光标记基因的小鼠淋巴细胞,检测放射及化学药物治疗的效果,寻找在肿瘤骨髓转移及抗肿瘤免疫治疗中复杂的细胞机制。应用可见光活体成像原理标记细胞,建立动物模型,可有效的针对同一组动物进行连续的观察,节约动物样品数,同时能更快捷地得到免疫系统中病原的转移途径及抗性蛋白表达的改变。
(3) 细胞凋亡
当荧光素酶与抑制多肽以融合蛋白形式在哺乳动物细胞中表达,产生的融合蛋白无荧光素酶活性,细胞不能发光,而当细胞发生凋亡时,活化的caspase-3在特异识别位点切割去掉抑制蛋白,恢复荧光素酶活性,产生发光现象,由此可用于观察活体动物体内的细胞凋亡相关事件。也可以通过使用特殊的底物,DEVD-luciferin,当发生细胞凋亡时,活化的caspase-3会切断DEVD与luciferin的连接,恢复荧光素酶与luciferin的相互作用而发光。
2. 标记病毒
(1) 病毒侵染
以荧光素酶基因标记的HSV-1病毒为例,可观察到HSV-1病毒对肝脏、肺、脾及淋巴结的侵和病毒从血液系统进入神经系统的过程。多种病毒,腺病毒,腺相关病毒,慢病毒,乙肝病毒等,已被荧光素酶标记,用于观察病毒对机体的侵染过程。
(2) 基因治疗
基因治疗包括在体内将一个或多个感兴趣的基因及其产物安全而有效的传递到靶细胞。可应用荧光素酶基因作为报告基因用于载体的构建,观察目的基因是否能够在试验动物体内持续高效和组织特异性表达。这种非侵入方式具有容易准备、低毒性及轻微免疫反应的优点。荧光素酶基因也可以插入脂质体包裹的DNA分子中, 用来观察脂质体为载体的DNA运输和基因治疗情况。
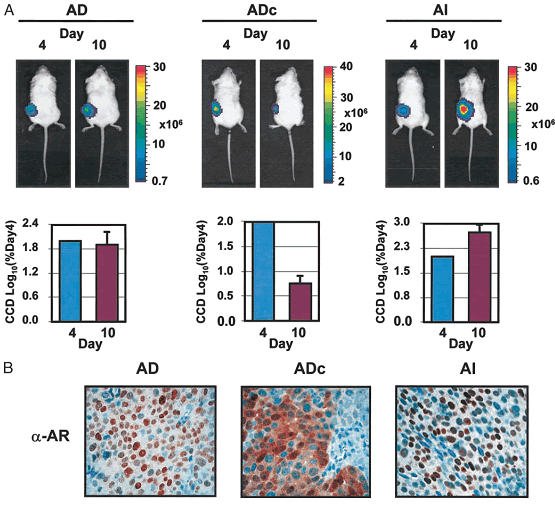
Interrogating Androgen Receptor Function in Recurrent Prostate Cancer1,2
Liqun Zhang, Mai Johnson, Kim H. Le, Makoto Sato, Romyla Ilagan, Meera Iyer, Sanjiv S. Gambhir, Lily Wu, and Michael Carey3
Departments of Biological Chemistry [L. Z., K. H. L., R. I., M. C.] and Urology [M. J., M. S., L. W.], Crump Institute of Molecular Imaging [S. S. G., L. W., M. C.], and Department of Molecular and Medical Pharmacology [M. I., S. S. G.], University of California, Los Angeles, School of Medicine, Los Angeles, California 90095
ABSTRACT
The early androgen-dependent (AD) phase of prostate cancer is dependent on the androgen receptor (AR). However, it is unclear whether AR is fully functional in recurrent prostate cancer after androgen withdrawal. To address this issue we interrogated AR signaling in AD and recurrent prostate cancer xenografts using molecular imaging, chromatin immunoprecipitation, and immunohistochemistry. In the imaging experiments, an adenovirus bearing a two-step transcriptional activation cassette, which amplifies AR-dependent firefly luciferase reporter gene activity, was injected into tumors implanted into severe combined immunodeficiency mice. A charge-coupled device optical imaging system detected the initial loss and then resumption of AR transcriptional activity in D-luciferin-injected mice as tumors transitioned from AD to recurrent growth. The results of chromatin immunoprecipitation and immunohistochemical
localization experiments correlated with the Ad two-step transcriptional activation imaging signal. AR localized to the nucleus and bound to the endogenous prostate-specific antigen enhancer in AD tumors but exited the nucleus and dissociated from the enhancer upon castration. However, AR reentered the nucleus and rebound the prostate-specific
antigen enhancer as the cancer transitioned into the recurrent phase. Surprisingly, RNA polymerase II and the general factor TFIIB remained bound to the gene throughout the transition. Our data support the concept that AR is fully functional in recurrent cancer and suggest a model by which a poised but largely inactive transcription complex facilitates reactivation by AR at castrate levels of ligand
3. 标记细菌
(1) 细菌侵染研究
可以用标记好的革兰氏阳性和阴性细菌侵染活体动物, 观测其在动物体内的繁殖部位、数量变化及对外界因素的反应。
(2) 抗生素药物
利用标记好的细菌在动物体内对药物的反应,医药公司和研究机构可用这种成像技术进行药物筛选和临床前动物实验研究。
4. 基因表达和蛋白质相互作用
(1) 组织特异性基因表达
荧光素酶(luciferase)是一类生物发光酶,其中的renilla荧光素酶和firefly荧光素酶分别识别不同的底物, 一种细胞可被这两种荧光素酶标记: renilla 荧光素酶基因由一组成性稳定表达的启动子驱动, 作为内参,反应细胞数量的变化; firefly荧光素酶基因由要研究的组织特异性启动子驱动。这样firefly荧光素酶发光信号的变化,在消除细胞数量变化的影响后就可反应特定的启动子在动物体内的表达活性。
(2) 蛋白质相互作用
观察细胞中或活体动物体内两种蛋白质的相互作用,是将荧光素酶基因分成两段,分别连接所研究的两种蛋白之一的编码DNA,然后导入细胞或动物体内表达为融合蛋白。当两种蛋白有强相互作用时,表达的荧光素酶两部分相互靠近形成有活性的荧光素酶,在有底物存在时出现生物发光,反映出所研究的两种蛋白存在相互作用。应用此原理亦可用于研究细胞信号传导途径。
(3) 阻断RNA
通过对比生物发光的变化,验证在成年小鼠体内,注射双链siRNA可以特异地阻遏基因表达。
5. 转基因动物模型
(1) 基因表达
为研究目的基因是在何时、何种刺激下表达,将荧光素酶基因插入目的基因启动子的下游,并稳定整合于实验动物染色体中,形成转基因动物模型。利用其表达产生的荧光素酶与底物作用产生生物发光,反应目的基因的表达情况,从而实现对目的基因的研究。可用于研究动物发育过程中特定基因的时空表达情况,观察药物诱导特定基因表达,以及其它生物学事件引起的相应基因表达或关闭。
(2) 各种疾病模型
研究者根据研究目的,将靶基因、靶细胞、病毒及细菌进行荧光素酶标记,同时转入动物体内形成所需的疾病模型,包括肿瘤、免疫系统疾病、感染疾病等等。可提供靶基因在体内的实时表达和对候选药物的准确反应,还可以用来评估候选药物和其它化合物的毒性。为药物在疾病中的作用机制及效用提供研究方法。
6. 荧光成像功能
用RFP标记病毒,动态检测病毒在体内的复制过程。
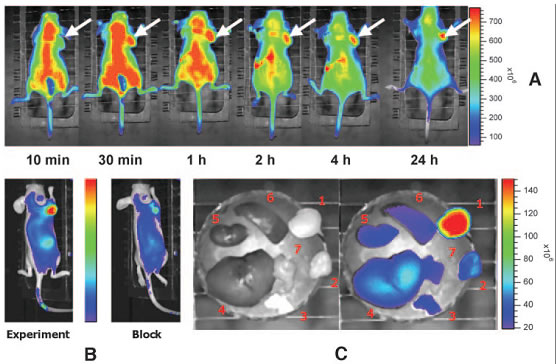
例:In vivo Near-Infrared Fluorescence Imaging of Integrin _v_3 in Brain
Tumor Xenografts
| | 关于细胞标记和荧光素酶的特性
1. 荧光素酶的发光是否需要激发光? 荧光素酶的发光是生物发光,不需要激发光,但需要底物荧光素(Luciferin)。
2. 荧光素酶的发光特性如何? 荧光素腹腔注射老鼠后约一分钟后表达荧光素酶的细胞开始发光,十分钟后强度达到稳定的最高点。在最高点持续约20-30 分钟后开始衰减,约三小时后荧光素排除,发光全部消失。最好的检测时间是在注射后15到35分钟之间

3. 底物荧光素(Luciferin)是如何进入小鼠体内的?需要多少? 荧光素是腹腔注射或尾部静脉注射进入小鼠体内的,约一分钟就可以扩散到小鼠全身。 大部分发表的文章中,荧光素的浓度是150mg/kg (见下图)。20克的小鼠需要3毫克的荧光素,价钱约两到三美元。常用方法是腹腔注射,扩散较慢,开始发光慢,持续发光长。若进行荧光素静脉注射,扩散快,开始发光快,但发光持续时间很短。
4. 荧光素的体内代谢过程 不同品牌的荧光素底物的代谢过程不太一样, 使用前最好做一些体外试验,做一个标准曲线。下面是我们试验的一些例子:

5. 两次观察间隔时间最短为多长时间? 观察时间的间隔没有最短限制, 只要观察的条件控制一致就可以。虽然底物在动物体内有一定的代谢过程,但是上一次底物的残留曲线可以知道(见上图),可以控制对下一次观察结果的影响。
6. 荧光素酶基因,荧光素酶,荧光素底物有多大?可以透过血脑屏障吗? 荧光素酶有554个氨基酸,约50KD。荧光素酶的底物荧光素,约280道尔顿。荧光素的水溶性和脂溶性都非常好, 很容易穿透细胞膜和血脑屏障。
7. 做体内实验的luciferin 与体外实验的是不是一样,如何购买?最小包装多大? 体内生物发光是用的是D-Luciferin,我们提供1g或小到100mg 的包装。
8. 如何保证荧光素酶(Luciferase)的稳定性? 荧光素酶基因是插到细胞染色体内的,当细胞分裂、转移、分化时, 荧光酶也会得到持续稳定的表达。荧光素酶的半衰期约三个小时, 所以只有活细胞才能够持续表达荧光素酶。
9. 标记的肿瘤接种以后,会发生luciferase的丢失吗? 没有正式的报道丢失Luciferase的情况。丢失的可能性及量非常小,不会影响实验结果。一些实验报道的结果中,标记的细胞在动物体内存活几年的时间还可以持续发光,说明Luciferase基因的标记非常稳定。
10. 在in vitro 的细胞培养中,为什么要经常用抗生素筛选? 荧光素酶基因标记的细胞株是经过单克隆筛选培养过的稳定的细胞株。体外培养过程中,不筛选也可以,只要时间不是很长, 接种代数不要很多。到目前为止,还没有发现基因丢失的情况。但若接种的代数过多,建议用药物筛选一段时间或从原始的细胞株培养以保证细胞发光的强度。
11. 可以用肿瘤块而不是细胞接种吗? 可以先用标记的细胞在皮下接种,然后从皮下取出肿瘤块进行原位接种。
12. 荧光素酶基因在标记的细胞中有多少个COPY,在什么位点? 细胞中的copy数目,和标记的位点对于实验没有任何影响,后来的实验中基本不进行那样的研究。
13. 标记细胞与标记基因所用的启动子有何不同? 标记细胞一般用在细胞内能稳定表达的启动子, 显示细胞的数目。标记基因一般用此基因的启动子,与此基因平行表达, 显示此基因的表达数目。
14. 荧光素酶的表达高低与所用启动子的活性有关吗? 有关,启动子的活性高,则荧光素酶的表达高,启动子的活性低,则荧光素酶的表达低。还可以根据此原理,用特定的启动子驱动荧光素酶,来观察该启动子在活体动物体内的特定条件下的表达情况,并检测影响该启动子表达的因素。这正体现了应用活体成像技术研究的优势。
15. 有几种常用的荧光素酶?特性如何? 常用的有两种荧光素酶,Luciferase 和 Renilla荧光素酶,二者的底物不一样,前者的底物是D-luciferin,后者的底物是coelentarizine 。二者的发光颜色不一样,前者所发的光波长在540-600nm,后者所发的光波长在460-540nm左右。前者所发的光更容易透过组织,后者在体内的代谢比前者快。大部分的发表文章通常使用前者用作报告基因, 也有一些文章使用两者进行双标记。
16. 组织切片可以观察到生物发光吗? 可以,但荧光酶的体外活性保持时间比较短, 约几十分钟。有相关的文献。
17. 标记好的细胞的荧光素酶是随机还是插入固定的位点? 插入的位点是随机的,但每一个构建好的细胞株我们都做过详细的分析,与其母细胞株进行详细的比较,证明荧光素酶的插入对细胞的各种特性(包括生长周期, 成瘤性等)没有造成影响。
18. 能标记病毒吗?能标记病毒的某一个基因吗? 可以标记病毒,由于病毒在核酸结构上的特性,每个病毒标记的方法不一样,具体的可以参见有关文献。还没有看到标记病毒某一个基因的报道, 但理论上讲,将荧光素酶基因与想标记的基因平行表达,可以标记任何基因。
19. 细菌标记问题 对于细菌标记,一般利用发光酶基因操纵子luxABCDE控制的编码荧光素酶的基因和编码荧光素酶底物合成酶的基因组成。 利用这种办法进行标记的细菌会持续发光,不需要外源性底物。但是一般细菌标记需要转座子的帮助把外源基因插入到细菌染色体内稳定表达。已经标记好了几十种革兰氏阴性和革兰氏阳性细菌,在这方面很有经验。具体标记情况请与我们直接联系。
关于仪器的特性等问题
20. 为何活体成像技术能看到体内发出的可见光? 两个主要原因使可见光成像技术能够看到体内发出的微弱的可见光。一是高灵敏度的制冷CCD镜头,可达到零下-105°C,使体内发出的非常少的光子也能够检测到。 二是绝对密封的暗箱装置,可以屏蔽包括宇宙射线在内的所有光线。
21. 正常成体小鼠可以看到体内发光吗? 是否不需要裸鼠? 可以。成体老鼠和裸鼠,幼鼠及胚胎的区别只在与对可见光的穿透性不同,我们的技术可以看到成体正常老鼠的体内发光。这正是这项技术的价值所在。可见光的穿透能力在3-4cm,所以大鼠也可以作为活体成像的动物, 并有很多关于大鼠的文章。
22. 能检测在组织内部的发光吗?光能透过肌肤多深? 可以。若有发光足够强的标记细胞,在老鼠体内任何一个地方都能看到约一立方毫米的细胞瘤(约106细胞)。穿透性可达到3-4CM (小鼠身体厚度约7-8 CM)。
23. 仪器灵敏度如何? 仪器对发光细胞检测的灵敏度与细胞发光的强度有关。在标记细胞活跃发光的情况下, 仪器可以检测到最少100个皮下接种的发光细胞。若细胞在体内位置深(如原位种植),比如内脏,最少能检测到的细胞数目需要多一些。一般每增加0.5cm可检测到的最少细胞数增加一个数量级。具体评论见BLOOD 2003 年的一篇文章: “the sensitivity of cell detection in vivo is surprisingly high and exceeds even the sensitivity of detection by flow cytometry ex vivo. As few as 7x103 cells are detectable in the lungs early after injection, 2-2.5x104 cells within liver or spleen, and as few as 1x104 tumor cells within the BM of a femur give rise to a sufficient signal to be detected externally. In other experiments using cells with even higher luciferase expression, as few as 100 cells can be reliably detected in the peritoneal cavity of living animals. BLOOD, 2003, V.101, pp640-8
24. 能检测分散在各处的单个细胞吗? 可以检测到流体的细胞,只要细胞总数达到100以上。许多文章,其中用荧光素酶标记了T细胞, NK细胞, 造血干细胞和其他淋巴细胞。在这些标记的细胞总数达到一百以上时,我们的仪器可以观察到信号(见上篇关于T细胞的索引)。
25. 活体成像技术如何定量分析? 活体可见光成像技术采取绝对光子数的计算方法,记录单位时间内、单位面积、单位角度接受到的光子数。这样,不同时间、不同仪器的测量结果可以进行比较,具有绝对的定量意义。每一个新标记的细胞株都要进行全面的定量分析才能用于定量实验,其中包括在体外和体内固定位置细胞发光的标准曲线。
26. 不同的组织对光的吸收程度不一样,不同的组织之间能进行定量研究吗? 不能。目前的文献都是同样的组织比较,进行同样组织的前后不同时间的定量分析。
27. 荧光素酶的发光强度是否同细胞的数量成正比? 是的,荧光素酶的发光强度同标记的靶点, 包括细胞、基因、细菌和病毒的数量成正比。密西根大学Brian Ross发表的一篇文章专门研究了这个问题。确定荧光素酶的发光强度与细胞数成正比关系,并且线性关系到0.9 以上。
28. 仪器的解析度如何?分辨率如何? 仪器的最高解析度在0.1毫米左右。由于可见光是漫射光,在体内走的路线不是直线,所以该仪器的体内光源的分辨率不是很好,通过该仪器观察的发光图片不能代表发光物质的结构信息,在动物体表所捕捉的发光信号只能代表发光的强度和大概的位置。小动物CT和MRI,在这方面具有优势,因为放射线走的路线很直。
29. 能定位在哪个脏器吗?凭什么?当进行肿瘤转移研究的实验时,在观察期间,不杀死动物,如何判断某一部位发光是由于皮肤、皮下组织,肌肉,脏器还是骨骼的肿瘤转移造成的发光?特别是对于一些较小的脏器,如淋巴结转移。 此技术无法直接定位标记细胞和基因所在的组织和器官。但是实验人员凭经验,可以靠发光细胞在老鼠的身体位置推断标记细胞或基因所在的脏器。若需要证实, 还需要将老鼠解剖,进行体外检测。
30. 拍摄普通照片的和生物发光照片的是一个CCD镜头吗? 是, 只不过爆光时间和快门不一样。
31. 镜头那么低温度,动物不会冻死吗? 低温只是在CCD镜头的小环境内。其它范围内都是室温。
32. 使用麻醉机相对于腹腔注射麻醉有什么优点? 麻醉系统可以对小鼠的麻醉情况包括时间,程度等有更精确的控制。使用起来也会更加方便。
33. 荧光配件相对于其他公司的荧光的优势在哪里? 相对宽的应用范围,可以观察波长在400-900nm的荧光,因此适用于GFP及各种荧光染料的标记。还有一套12张专门的滤光片用来消除非特异性的背景光。并且其成像速度快,适合大批量的实验。
关于生物发光与荧光及其它技术的比较
34. 荧光检测与生物发光检测的优势与劣势比较如何? 荧光发光需要激发光,但生物体内很多物质在受到激发光激发后,也会发出荧光,产生的非特异性荧光会影响到检测灵敏度。特别是当发光细胞深藏于组织内部,则需要较高能量的激发光源,也就会产生很强的背景噪音。作为体内报告源,生物发光较之荧光的优点之一为不需要激发光的激发, 它是以酶和底物的特异作用而发光, 且动物体自身不会发光,这样生物发光就具有极低的背景。虽然荧光信号远远强于生物发光,但极低的自发光水平使得生物发光的信噪比远高于荧光。另外,生物发光信号可以用于精确定量。因为荧光酶基因是插入细胞染色体中稳定表达的,单位细胞的发光数量很稳定。 即便标记细胞在动物体内有复杂的定位,亦可从动物体表的信号水平直接得出发光细胞的相对数量。而对于荧光,光在体内路径较长。信号水平取决于激发光的强度、发光细胞的数量、靶点的深度,光线穿过的组织对其的吸收及散射等因素,使得荧光强度很难定量。 因为这些原因,目前大部分高水平的文章还是应用生物发光的方法来研究活体动物体内成像。 但是,荧光成像有其方便,便宜,直观,标记靶点多样和易于被大多数研究人员接受的优点,在一些植物分子生物学研究和简单的动物体内研究方面也得到应用。对于不同的研究,可根据两者的特点(表1)以及实验要求,选择合适的方法。
表1 生物发光及荧光特点的比较 | | 优 点 | 缺 点 | | 生物发光 | 高灵敏度
对环境变化反应迅速
成像速度快,图像清楚
在体内可检测到102细胞 | 信号较弱, 需要灵敏的CCD镜头
需要注入荧光素
仪器精密度要求高
细胞或基因需要标记 | | 荧光 | 多种蛋白及染料可用于
多重标记,标记相对简单
可同时用于FACS分类
未来可能用于人体 | 非特异性荧光限制了灵敏度
体内检测最低约106细胞
需要不同波长的激发光
很难精确体内定量 | 35. 为什么用荧光素酶, 而不是用绿色荧光蛋白来检测体内发光? 一方面是荧光素酶的偏红光比绿色荧光蛋白的绿光在体内的穿透性要强近一百倍。另一方面, 荧光 素酶是靠酶和底物的相互反应发光,特异性很强。这样一来,得到的信噪比很高。而荧光蛋白需要激发光来产生反射光。老鼠的毛皮、肌肤以及一些食物都会产生非特异性荧光,造成很强的非特异性背景光,得到的信噪比很小。虽然荧光蛋白的发光强度很高,大量应用于体外检测;但荧光酶标记的方法更适合于体内检测。荧光酶体内检测的灵敏度要比荧光蛋白在体内的灵敏度至少高三个数量级(1000倍)。
36. 发光的波长与体内的穿透性如何关系? 荧光素酶发出的光主要是偏红光,与绿色荧光蛋白(GFP)的绿色荧光不同。荧光素酶的偏红光比绿色荧光蛋白的绿光在体内的穿透性要强近一百倍。因为光在哺乳动物组织内传播时会被散射和吸收,不同类型的细胞和组织吸收光子的特性并不一样。血红蛋白(hemoglobin)是造成体内可见光被吸收的主要因素,其吸收可见光中蓝绿光波段的大部分。但是在可见光大于600纳米的红光波段,血红蛋白的吸收作用却很小。因此,在偏红光区域, 大量的光可以穿过组织和皮肤而被检测到。
37. 相对于传统技术,生物发光成像技术的优势在哪些研究领域? 该技术是一项在某些领域有很大不可替代优势的技术,但是并不是万能的技术。与传统技术相比,肿瘤转移研究,基因治疗,流行病学的发病学研究,干细胞示踪,白血病的相关研究等是该技术非常有优势的领域。在药物开发方面,用该技术进行肿瘤的药效研究,比传统方法更灵敏,还可以通过一系列转基因疾病动物模型,来快速直观的进行相关疾病的发病机理和药物筛选研究。
38. 生物发光成像不能标记的领域? 小分子药物,多肽等。这些方法现今为止的最好的标记方法还是以放射性标记。
39. 生物发光成像和小动物CT比较有什么特点和优势? 小动物CT的基本原理是利用X射线成像,通过对所观察对象的密度变化,进行动物内部结构方面的研究。他的优点是分辨率高,不需标记。缺点是特异性差, 在肿瘤很小时无法区分肿瘤细胞和正常细胞,并且对于肿瘤细胞的活跃程度不敏感。如2005年1月JCI的一篇关于乳腺癌骨转移的文章里,详细比较了小动物CT与生物发光成像在肿瘤转移方面的灵敏度。小动物CT要在接种16天以后,成瘤很明显后才能够观察到骨转移的存在。而生物发光成像在接种后当天就可以实时观察到癌细胞的转移和走向。并且,小动物CT需要对动物有较强的X-射线照射, 容易引起突变,对动物的生理有一定影响。
40. 小分子药物的标记用荧光与PET,哪一个更好? 如果用荧光蛋白,可以标记细胞或病毒。 如果使用合适的荧光小分子, 如Cyt5.5等,可以标记蛋白例如抗体等大分子或者多肽。但是再小的分子如小分子药物等,只能用放射性同位素标记, 用PET或SPECT的方法进行研究。 因为即使荧光基团如Cyt5.5也会影响小分子药物的药理药效和代谢活动。
41. 体内可见光技术和其它体内成像技术(PET, CT, 及MRI)的比较 简单优点:适用于小动物的研究,灵敏度高,特异性好,操作简单,无放射性,价钱便宜。缺点:无法标记小分子药物,暂不适用于人类和临床(正在研究中),分辨率低,体内精确定位有限。
关于技术应用
42. 可以用荧光素酶基因标记干细胞吗?如何标记? 可以,标记干细胞有几种方法。一种是标记组成性表达的基因,做成转基因小鼠,干细胞就被标记了,从此小鼠的骨髓取出造血干细胞,移植到另外一只小鼠的骨髓内,可以用该技术示踪造血干细胞在体内的增殖和分化及迁徙到全身的过程。另外一种方法是用慢病毒标记神经干细胞。以上内容都有相关的文献报道。
43. 该技术在抗肿瘤新药研究方面的应用如何? 在用该技术进行抗肿瘤新药的研究方面,主要是药效学评价。用活体成像的方法比传统技术有更高的灵敏度,当用传统的方法,还不能检测到瘤块时,用该技术已经可以检测到很强的信号。还有由于该技术只是检测活跃的细胞,那些已经凋亡的癌细胞是检测不到的,而用传统的方法,不能区别正常的癌细胞与凋亡的癌细胞,所以该技术可以比传统技术更早的发现药物的疗效,比传统方法更灵敏。目前已经应用该技术进行的抗肿瘤药效研究的有SU11248(乳腺癌新药),Topotecan(已经上市的抗肿瘤) 等。
44. 蛋白质与蛋白质的关系,如何研究? PNAS(美国科学院院报)上发表的一篇文章介绍,可利用体内可见光成像技术研究活体动物体内蛋白与蛋白的相互作用。具体方法是:将分开时都不单独发光的荧光酶的C端和N端分别连接在两个不同的蛋白质上,若是这两个蛋白质之间有相互作用,,荧光酶的C端和N端就会被带到一起, 产生发光现象.。详细内容见文章。
45. 可以研究药物对蛋白质相互作用吗? 可以。在活体条件下应用该技术研究药物对蛋白质相互作用的影响。可以把在体外实验中无法模拟的活体环境对蛋白质相互作用的影响也计算在内(PNAS04)。
46. 可以研究蛋白质核运输吗? 可以。研究方法类似于研究蛋白质相互作用的方法。在荧光素酶基因的一端接要研究的蛋白质的基因,另一端接肯定在细胞核内表达的蛋白的基因,当核外的蛋白运输到核内时,就会导致荧光素酶N断、C端靠近,恢复发光。
47. 可以用该技术研究基因表达吗? 可以,研究基因表达可以从影响基因表达的各个不同的层面进行相关的研究,如利用融合蛋白(p27-luc融合蛋白研究其在Cdk细胞分裂周期的表达Nature Medicine 2004), 兴趣基因启动子控制的荧光素酶(Catenin在肿瘤转移的信号传导机制Nature 2005), iRNA方式(HCV-luc的iRNA抑制表达Nature 2002), 和转基因动物(NFkB在Hypoxia的表达JCI 2004)等方法。若有兴趣,可以与我们索取相关文章。
48. 细胞凋亡的研究 PNAS(美国科学院院报)上发表的一篇文章介绍,可利用体内可见光成像技术直接观察活体动物体内的细胞凋亡(附上细胞凋亡的文章)。具体方法是:用分子生物学方法在荧光酶的两端连接上抑制其发光的蛋白(如雌激素),但在其连接处加上CASPASE(细胞凋亡时特异表达的一种酶)的酶切点。细胞发生凋亡时,表达CASPASE,切开抑制荧光酶发光的蛋白,使荧光酶开始发光。详细内容见文章。
49. 该技术只是能示踪细胞的走向,而不能进行相关的机理研究? 不对。该技术最初的应用是在观察肿瘤细胞、病原微生物或干细胞的走向,分布等,但是目前随着该技术的普及,其应用已经扩展到很多方面,原来只能在分子水平上研究的内容,现在也可以在整体动物水平上进行更接近活体环境状态的研究,如蛋白质相互作用,细胞凋亡,基因表达等等。 基本上把分子生物学在体外的一些研究方法在体内进行实现。由于体内与体外的各种微环境上的差异,造成体外实验结果对活体生物机理研究的局限性,相信在整体水平的研究,必将有广阔的发展空间。
50. 在药物临床前研究中的应用如何? 利用活体成像技术高灵敏度,观察方便的特点,在抗肿瘤药物临床前研究中,通过给予肿瘤接种的小鼠不同的剂量,并不同的给药时间、不同的给药途径,观察抗肿瘤药物的最佳给药途径、给药剂量并给药时间,从而制定合适的剂型与服药时间。我们搜集了许多药物研究方面的相关文献,请同我们联系, 希望与您共享。
51. 相对于传统技术,在肿瘤学研究中的优势在哪里? 有更高的灵敏度,可以定量研究,可以方便的观察肿瘤转移与复发的情况,可以避免由于宰杀老鼠而造成的组间差异,可以节省动物的成本。 并且应为这项技术的超灵敏性,微小的肿瘤转移兆(少到100多个细胞)就可以检测到。 比用传统方法可以检测到的灵敏度大大提高。也可应用转基因技术制作自发肿瘤模型从事相关的研究。
52. 如何利用该技术研究药物代谢? 标记与药物代谢有关的基因,比如CYP3A4等,研究不同的药物对该基因表达的影响,从而可以间接知道相关药物在体内代谢的情况。并且,小分子及多肽药物也可以利用荧光素(如Cyt 5.5等)标记, 观察它们在动物体内的走向,变化及代谢等。
53. 如何进行相关疾病机理的研究? 可以标记与某种疾病密切相关的基因,做成转基因小鼠,通过特定的药物作用或其他条件下,该基因表达的变化,来推测该疾病的发病机理,药物对该疾病治疗的效果等。我们已经标记好了几十种转基因动物提供给研究人员,也提供相关方面的服务。
54. 在中医学方面的应用前景如何? 由于该技术在整体动物水平上观察生物学变化,与中医的整体观念有些相似。目前,有很多中药在治疗疾病上有很好的疗效,但是由于其复杂的组分,复杂的作用机理,很难用目前的分子水平的研究解释清楚。如果从宏观的水平,根据所研究内容的不同,应用该技术的一些疾病模型,从基因表达等方面观察某些中药的治疗效果,将是一个不错的方向。台湾的中医学界在这个方面有很深的研究。
55. 在免疫学领域应用如何? 观察流体细胞在体内的动向和变化使这个技术的一大优势。 可以标记免疫细胞,如T 细胞,NK细胞,观察免疫细胞对肿瘤细胞的识别和杀死。也可以标记干细胞及异体细胞,观察干细胞烟花和器官移植的研究。也有一些关于免疫因子的研究报道等。
56. 在RNA阻断方面的应用如何?可以标记siRNA吗? 可以用荧光素酶基因标记兴趣基因,利用荧光素酶的iRNA观察其对兴趣基因的表达抑制(Nature 2002). 也可以标记肿瘤细胞,间接观察阻断RNA对肿瘤细胞的识别和杀伤。
57. 相对传统技术,在抗生素药物筛选方面的优势如何? 同一批老鼠持续观察,避免个体间差异; 有更高的灵敏度,可以在感染早期就进行活体观察。可以有结构信息,在活体动物整体上观察感染途径。定量,可以比较各个器官的感染程度,更直观。 | |


 不适合。由于荧光标记检测的灵敏度,以及荧光检测的深度等限制,活体光学成像不是很适合进行小分析药物活体示踪的实验。核素标记的PET和SPECT技术由于检测的深度、灵敏度以及标记的原因是适合进行小分析药物活体示踪实验的技术,该领域是一个正在蓬勃发展的领域,但是由于GE、西门子等公司的相关产品价格昂贵,很难满足大多数科研工作者的需要,所以一时间该技术没有得到普及和应用。但是国外有一些公司正在开发价格适中的产品,不久就会进入中国市场,将使中国的科研工作者应用该技术进行小分子药物的吸收、分布、代谢、分泌等研究变的方便起来。该技术可以实现三维成像,详细了解标记物的位置。应用该技术进行骨骼代谢的例子见右图:
不适合。由于荧光标记检测的灵敏度,以及荧光检测的深度等限制,活体光学成像不是很适合进行小分析药物活体示踪的实验。核素标记的PET和SPECT技术由于检测的深度、灵敏度以及标记的原因是适合进行小分析药物活体示踪实验的技术,该领域是一个正在蓬勃发展的领域,但是由于GE、西门子等公司的相关产品价格昂贵,很难满足大多数科研工作者的需要,所以一时间该技术没有得到普及和应用。但是国外有一些公司正在开发价格适中的产品,不久就会进入中国市场,将使中国的科研工作者应用该技术进行小分子药物的吸收、分布、代谢、分泌等研究变的方便起来。该技术可以实现三维成像,详细了解标记物的位置。应用该技术进行骨骼代谢的例子见右图: 





