产1,3-丙二醇基因工程菌发酵条件的研究
2006-09-17 17:24:47 来源:不详 评论:0 点击:
1,3-丙二醇(1,3-propanediol,简称1,3-PD)是一种重要的化工原料,可用作溶剂、抗冻剂或保护剂、精细化工原料以及新型聚酯———聚对苯二甲酸丙二醇酯(PTT)和聚氨酯的单体。最近研究表明,PTT是一种新型聚酯材料,可用于地毯、工程塑料、膜及服装材料,因此全世界各大公司都竞相研发和试验以探索成本更低的1,3-丙二醇工业化生产途径。目前主要用化学方法合成1,3-PD,此方法需要在高温、高压及贵重催化剂存在的情况下才能实现。因此,设备投资大,技术难度高,产品分离纯化困难,特别是催化剂的制备较难,且产生CO等废气污染环境。而微生物发酵法生产1,3-PD具有条件温和、操作简单、副产物少、绿色环保等优点,所以这方面的研究成为当前国内外研究的热点[1,2]。
传统的微生物发酵法通常是以克雷伯氏菌(Klebsiellapneumoniae)、丁酸梭状芽孢杆菌(Clotridiabutyricum)等天然菌进行甘油的厌氧发酵生成1,3-PD。但该方法存在生产周期较长、甘油转化效率低、原料成本高等问题,是实现大规模应用前需要克服的障碍[3]。利用基因工程的方法将甘油转化为1,3-PD的相关酶即甘油脱水酶基因dhaB和1,3-丙二醇氧化还原酶基因dhaT在大肠杆菌中进行表达的研究在国外早有报导[4,5]。在此基础上结合代谢工程的原理和方法,以丰富且廉价的碳水化合物资源(如淀粉、葡萄糖等)为底物发酵生产1,3-PD的研究取得很好的突破[6]。利用工程菌生产1,3-PD具有生产工艺简单、成本低廉、副产物少、产物分离简单等优点,近年来已越来越受到国内外研究人员的重视[3,6]。
本实验室从2003年起先后在大肠杆菌中成功地表达了dhaB和dhaT基因[7,8],在利用基因工程菌生物转化甘油生成1,3-PD的研究中取得良好的进展。本实验侧重于重组菌株JM109/pSE dhaB dhaT在以甘油为底物生成1,3-PD发酵条件的探索,在微好氧条件下尝试以廉价的乳糖代替IPTG(异丙基硫代 β D 半乳糖苷)作为诱导物、以维生素B12代替辅酶B12,并对其工艺特点和发酵条件进行初步的研究,为规模化生物合成1,3-PD作有意义的探索。
1 材料和方法
1.1 菌种与仪器
重组质粒pSE380.dhaB和pSE380.dhaT由本实验室构建[7,8],大肠杆菌JM109为本实验室保存。
BeckmanDU640紫外可见分光光度器,用于600nm处进行细胞浓度检测。
发酵罐采用全自动的德国产品,型号为B BraunBiotechBioSTATDL30。
1.2 培养基
LB培养基(质量分数):蛋白胨1.0%、酵母膏0.5%、NaCl1.0%,pH7.0,用于细菌培养;
种子培养基:蛋白胨1.6%、酵母膏1.0%、NaCl1.0%,pH7.0,培养基中加入的氨苄青霉素(Amp)终质量浓度为100μg/mL;
发酵培养基:参照参考文献[5],每升含:甘油5g,葡萄糖5g,乳糖5g,Na2HPO46g,KH2PO3g,NH4Cl2g,NaCl0.5g,MgSO42mmoL,酵母粉5g,高压蒸汽灭菌;氨苄青霉素100mg,采用微滤膜过滤除菌;
补料培养基:每升含甘油20%,葡萄糖2.0%,乳糖2.0%,115℃灭菌15min;
维生素B12:添加量为发酵培养基终质量浓度10mg/L,采用微滤膜过滤除菌;
微量元素组分见参考文献[9],采用微滤膜过滤除菌。
1.3 含多顺反子的重组质粒的构建及产1,3-PD的代谢途径
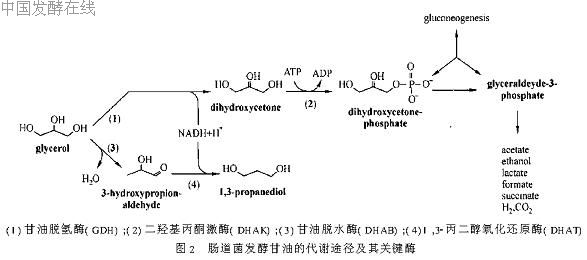
首先用PCR的方法从重组质粒pSE380.dhaT上扩增出含RBS(核糖体结合部位)序列的dhaT基因,连接于重组质粒pSE380.dhaB的多克隆位点中,构建由单个启动子trc带动两个基因表达的多顺反子(见图1),重组质粒命名为pSE dhaB dhaT,酶切鉴定含该多顺反子的重组质粒的正确性后,将它转化到大肠杆菌JM109中进行表达,尝试在大肠杆菌中构建一条新的类似于克雷伯氏菌(K pneumoniae)代谢甘油产生1,3-PD的代谢途径[10](见图2)。由于在此多顺反子中dhaB和dhaT这两个外源基因含有各自的RBS序列以及翻译起始和终止信号,所以能独立翻译出甘油脱水酶(DHAB)和1,3-丙二醇氧化还原酶(DHAT)两个异源蛋白(实验结果没有公开发表)。所运用的基因操作、质粒提取、大肠杆菌感受态细胞制备和转化等操作按参考文献[11]进行。
图1 含dhaB基因和dhaT基因多顺反子构建图
1.4 重组菌株JM109/pSE dhaB dhaT以甘油为底物发酵生产1,3-PD
将重组菌株JM109/pSE dhaB dhaT单菌落接种到含有Amp(100μg/mL)的LB培养基中,培养过夜,第2天以2%(体积分数)的菌液量接种于种子培养基中,30℃振荡培养至OD600为0.5~0.7时,再以4%(体积分数)量接种于盛有20L发酵培养基的发酵罐中,搅拌转速250r/min,37℃发酵培养60h,发酵8h后开始流加补料培养基,每隔2h取2mL发酵液进行细胞浓度检测;并对发酵液离心取上清液,以气相色谱仪监测甘油和1,3-PD的含量。在发酵过程中,通过流加补料培养基的方式将甘油质量分数控制在1.0%~1.5%,以40%(质量分数)柠檬酸和5mol/LKOH来控制发酵液pH为7.0。
1.5 1,3-PD的气相色谱分析
色谱工作条件:日本岛津GC 9A气相色谱仪,氢火焰离子化检测器,色谱柱为内径3mm,长2m不锈钢柱,填充国产高分子微球GDX 101(60.80目)为固定相;汽化室温度为290℃;检测室温度为220℃;载气:氢气600mL/min,空气400mL/min。进样量为1μL,分别以1%(质量分数)分析纯1,3-PD和甘油为标样测定1,3-PD和甘油的含量。
2 结果与讨论
2.1 重组菌株以甘油为底物发酵产物的分析
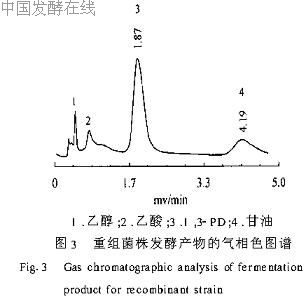
发酵期间每隔2h取样,分别进行发酵液中的1,3-PD浓度、菌体密度、甘油含量指标的测定,图3为发酵液的气相色谱图,可见1,3-PD和甘油的保留时间分别为1.87min和4.19min。
2.2 重组菌在发酵罐中的发酵动态
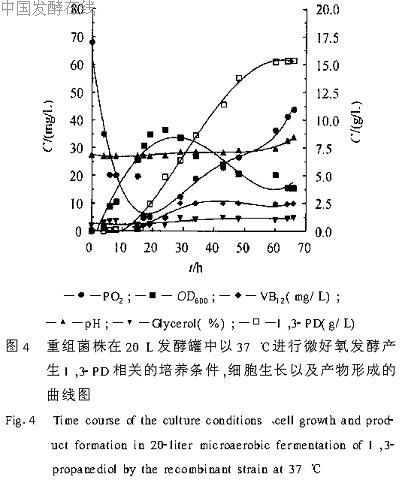
图4为重组菌在发酵罐中的发酵动态曲线,发酵温度37℃,发酵历时60h。在发酵24h左右得到菌体的最大OD600值为35.2,发酵10h时开始检测到1,3-PD。整个发酵过程甘油总消耗量约860g,重组菌株在60h时1,3-PD的产量到达最高值,约为15.34g/L,共计307g,甘油总转化率为35.7%。
2.3 甘油脱水酶与维生素B12
在生物转化甘油生成1,3-PD的代谢途径中,甘油脱水酶在辅酶B12存在的情况下催化甘油脱水生成中间产物3.羟基丙醛(3.HPA),再由1,3-丙二醇氧化还原酶将3.羟基丙醛(3.HPA)催化生成1,3-PD,因此辅酶B12对甘油脱水酶的活性有着非常重要的作用,来源于克雷伯氏菌的甘油脱水酶完全依赖辅酶B12作为辅酶才能产生活性[4,5]。由于辅酶B12价格昂贵而无法进行大规模应用,加上大肠杆菌不能从头合成辅酶B12,只能在以钴啉醇酰胺物质作为前体并在诱导条件下启动自身的cob调节子合成辅酶B12,所以在用重组大肠杆菌表达甘油脱水酶发酵生成1,3-PD过程中,在培养基中加入终浓度为10mg/L的维生素B12,可以作为合成辅酶B12的前体,使甘油脱水酶得以重新激活[10,12,13]。本研究通过更加廉价的维生素B12代替辅酶B12进行发酵,结果如图4,有1,3-PD产生和积累,但产量比较低。
2.4 表达载体pSE380的trc启动子
在大肠杆菌中高效地表达异源蛋白,必须将相关基因置于可诱导的强启动的控制之下[14]。在表达载体pSE380中,含有由启动子tac改组而来并可用IPTG诱导的杂交型强启动子trc[15]。本实验将外源dhaB基因和dhaT基因构建由单个启动子trc带动的多顺反子表达质粒,它可以在大肠杆菌中进行IPTG诱导表达,并能独立翻译出具有很高生物活性的DHAB和DHAT两种异源蛋白(实验结果没有发表)。由于IPTG对细胞具有毒性并且价格昂贵,限制了它在工业化生产中的应用,Hsih等[16]报导可以用乳糖作为诱导物来代替IPTG对启动子tac和trc进行诱导。本次发酵首次补加乳糖而不是IPTG作为诱导物,对基因的诱导表达有一定的效果。从图4可以看出,重组大肠杆菌培养10h后开始有1,3-PD产生,并呈直线上升趋势,到60h时1,3-PD产量达到最高值。
2.5 氧对转化的影响
一般情况下,氧的存在不利于1,3-PD产生,因为氧引起代谢途径中两个关键酶,也是本研究构建重组质粒所表达的两个酶即DHAB和DHAT失活[17,18]。但在厌氧条件下,并不利于大肠杆菌宿主的生长。为了解决有氧对酶失活的影响和厌氧对宿主生长不利的矛盾,我们在上罐发酵过程中于前期供给少量的氧,可以得到较高的菌体生长密度,即发酵24h时菌体OD600为35.2,在发酵后期的转化阶段,停止通入空气(也不补加H2和N2),这样就可以将溶氧控制在30%以下。研究表明在微氧条件下,所采用的重组菌依然能转化甘油生成1,3-PD,如图4。
2.6 甘油浓度对转化的影响
甘油脱水酶不仅对氧敏感而容易失活,而且在有甘油存在时,它也会发生自杀失活(suicideinacti vation),当有激活蛋白、ATP、Mn2+或Mg2+、辅酶等因子共同作用下可以将失活甘油脱水酶重新激活[10];也有研究表明,以含有克雷伯氏菌dha调节子的重组大肠杆菌进行厌氧甘油发酵时,过高的甘油浓度会增加3.磷酸甘油(G3P)的积聚从而明显抑制菌体的生长和1,3-PD产生,当培养基中甘油质量分数达到0.5%时,开始呈现出这种影响[19]。由于甘油浓度过低也不利于1,3-PD的生成[20],所以在发酵过程的中后期通过匀速流加20%(质量分数)的甘油,使甘油维持在1.0%(质量分数)左右,有利于1,3-PD的生成。同时补加适量的葡萄糖作为菌体生长的优先碳源,以提高甘油的转化率。
3 结 论
在大肠杆菌JM109中成功地用克雷伯氏菌(K pneumoniae)的甘油脱水酶基因dhaB以及1,3-丙二醇氧化还原酶基因dhaT进行了共表达,所构建的工程菌能转化甘油产生1,3-PD,使原来不产1,3-PD的大肠杆菌能发酵甘油生成1,3-PD。对所构建的重组菌JM109/pSE dhaB dhaT进行小体积发酵研究,尝试在不添加IPTG而是用廉价的乳糖作为诱导物、以维生素B12代替昂贵的辅酶B12进行微好氧发酵的探索。初步研究结果表明,1,3-PD产量为15.34g/L,甘油转化率为35.7%。尽管1,3-PD产量比用克雷伯氏菌(K pneumoniae)原始菌株发酵的最高产量73.3g/L[21]还有很大差距,但可以通过优化发酵条件(优化培养基成分、补加适量的葡萄糖、控制溶氧量、改变诱导物、保持合适的菌体密度等)来大幅度提高1,3-PD的产量。同样,该重组菌在营养要求简单、不需要厌氧环境等复杂的发酵工艺方面显示很好的应用前景。
美国杜邦公司将甘油生产菌酿酒酵母(Saccha romycescerevisiae)中3-磷酸甘油脱氢酶基因DAR1、3-磷酸甘油脂酶基因GPP2以及克雷伯氏菌(K pneumoniae)的甘油脱水酶基因dhaB、大肠杆菌中非特异性的氧化还原酶基因yqhD在一株大肠杆菌中共表达,该工程菌能转化廉价的葡萄糖直接生成1,3-PD,其产量高达129g/L[22],这是目前文献报道的最高产量。本实验室和南宁中诺生物工程有限责任公司合作,已采用类似的技术路线,利用来自于丁酸梭状芽孢杆菌(C butyricum)等的甘油脱水酶基因进行基因工程菌的构建,利用葡萄糖作为原料直接发酵产生1,3-PD的实验也已获得成功,结果将另文发表。
本研究采用重组菌发酵仅仅是生物转化葡萄糖生成1,3-PD过程中甘油转化阶段的一个探索。它是在不需要IPTG为诱导物,不直接添加辅酶B12为辅酶,不需要严格厌氧环境下得出结果,这将为发酵法合成1,3-PD的研究提供新的有现实意义的思路。
参考文献:略
上一篇:超高浓度培养基条件下酵母细胞生长及酒精生成的准稳态动力学研究
下一篇:微生物驱油:基础理论期待突破
评论排行
- ·中国发酵企业数据库(4)
- ·(4)
- ·CoQ10高产菌株选育的研究进展(2)
- ·抗生素发酵工艺所用冷却塔的性能分析及处理(1)
- ·微生物菌种选育技术.rar(1)
- ·发酵生产染菌及其防治(1)
- ·赤藓糖醇发酵工艺研究(1)
- ·重组AiiA 蛋白可溶性表达及发酵条件优化(1)
- ·生物反应器设计软件_发酵罐绿色版(1)
- ·酵母粉、酵母浸粉的区别(1)
- ·雷帕霉素研究进展(1)
- ·透明质酸用途和行业概况(1)
- ·黄酒制作工艺(1)
- ·水解(酸化)工艺与厌氧发酵的区别(1)
- ·糖蜜酒精废液处理过程中产生的微生物蛋...(1)
- ·紫杉醇高产菌发酵产物的分离、纯化和鉴定(1)

